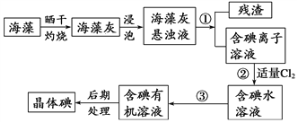
题目内容
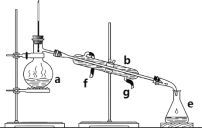
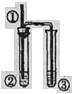
【题目】实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH![]() CH2=CH2+H2O,CH2=CH2+Br2―→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
CH2=CH2+H2O,CH2=CH2+Br2―→BrCH2CH2Br。用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:

有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在装置c中应加入________(选填序号),其目的是吸收反应中可能生成的酸性气体。
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)装置b的作用是___________。
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的________(填“上”或“下”)层。
(4)若产物中有少量未反应的Br2,最好用________(填正确选项前的序号)洗涤除去。
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),但不用冰水进行过度冷却,原因是___________________________。
(6)以1,2二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2二溴乙烷通过反应①制得A,A通过反应②制得氯乙烯,由氯乙烯制得聚氯乙烯。
①________________(填反应类型) ②________________(填反应类型)
A________________(填该物质的电子式)
写出第一步反应①的化学方程式_______________________________。
【答案】 ③ 防倒吸 下 ② 1,2二溴乙烷的凝固点较低(9 ℃),过度冷却会使其凝固而使气路堵塞 消去反应 加成反应 H:CC:H 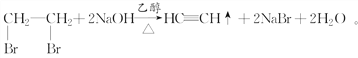
【解析】a中乙醇在浓硫酸的存在下在170℃脱水生成乙烯,由于浓硫酸的强氧化性、脱水性导致生成的乙烯气体中含有杂质二氧化硫、二氧化碳、水蒸气等杂质;b为安全瓶,可以防止倒吸;装置c中可以用氢氧化钠溶液吸收乙烯中杂质气体;d中乙烯与溴反应,装置e冷却可避免溴的大量挥发;f是尾气吸收装置。
(1)乙烯气体中含有杂质二氧化硫、二氧化碳、水蒸气等酸性杂质,用碱性试剂吸收,饱和碳酸氢钠不能吸收二氧化碳,故选用氢氧化钠吸收;故答案为:③;
(2)b为安全瓶,可以防止倒吸,故答案为:防倒吸;
(3)1,2-二溴乙烷密度比水大,所以加水,振荡后静置,产物应在下层,分离得到产品,故答案为:下;
(4)Br2与氢氧化钠反应,1,2-二溴乙烷不溶于水溶液,故选用氢氧化钠溶液吸收少量未反应的Br2;故答案为:②;
(5)反应过程中需用冷水冷却(装置e),但不用冰水进行过度冷却,因为1,2二溴乙烷的凝固点较低(9 ℃),过度冷却会使其凝固而使气路堵塞,故答案为:1,2二溴乙烷的凝固点较低(9 ℃),过度冷却会使其凝固而使气路堵塞;
(6)以1,2-二溴乙烷为原料,制备聚氯乙烯,可以先用1,2-二溴乙烷通过消去反应制得乙炔,然后通过乙炔与氯化氢的加成反应制得氯乙烯,最后由氯乙烯通过加聚反应制得聚氯乙烯,反应①为1,2-二溴乙烷通过消去反应制得乙炔,反应为:![]() ,②为乙炔与氯化氢的加成反应制得氯乙烯,
,②为乙炔与氯化氢的加成反应制得氯乙烯,
故答案为:消去反应;加成反应;H:CC:H ;![]() 。
。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】用如图所示装置进行实验,实验现象与对应的结论均正确的是
装置 | ① | ② | 实验现象 | 结论 | |
| A | 铜丝 | 稀硝酸 | ②出现红棕色气体 | 硝酸与铜生成了NO2③中需要碱溶液吸收尾气 |
B | 底端灼热的碳棒 | 浓硝酸 | ②中出现红棕色气体 | 产生气体一定是混合气体 | |
C | 铜丝 | Fe2(SO4)3溶液 | ②中溶液黄色变浅 | Cu与Fe2(SO4)3溶液发生置换反应 | |
D | 铁丝 | 浓硫酸 | 无明显现象 | 铁与浓硫酸不反应 |
A. A B. B C. C D. D