题目内容
13.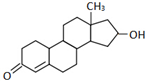 “诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图所示.下列关于“诺龙”的说法中错误的是( )
“诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图所示.下列关于“诺龙”的说法中错误的是( )| A. | 分子式是C18H26O2 | |
| B. | 能发生银镜反应 | |
| C. | 既能发生加成反应,也能发生酯化反应 | |
| D. | 既能发生氧化反应,也能发生还原反应 |
分析 根据结构简式确定分子式;该物质中含有羰基、碳碳双键、醇羟基,具有酮、烯烃和醇的性质,能发生氧化反应、消去反应、加成反应、酯化反应等,据此分析解答.
解答 解:A.根据结构简式知其分子式为C18H26O2,故A正确;
B.该物质中不含醛基,所以不能发生银镜反应,故B错误;
C.该物质中含有碳碳双键和羰基、醇羟基,能发生加成反应、酯化反应,故C正确;
D.该物质中含有碳碳双键和羰基、醇羟基,能发生氧化反应、还原反应,故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,侧重考查醇、酮和烯烃性质,明确官能团及其性质关系是解本题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.化学在生产和日常生活中有着重要的应用.下列说法正确的是( )
| A. | 人类利用的能源都是通过化学反应获得的 | |
| B. | 电解熔融氯化钠,可制得金属钠 | |
| C. | 金属表面形成的氧化物都能起到保护内层金属的作用 | |
| D. | 在铁水闸上外接电源的正极,可保护铁水闸 |
8.甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)═CH3OH(g)△H1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
(1)已知
则△H1=-99kJ.mol-1
(2)图1中能正确表现反应①的平衡常数K随温度变化关系的曲线为a(填曲线标记字母),判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.
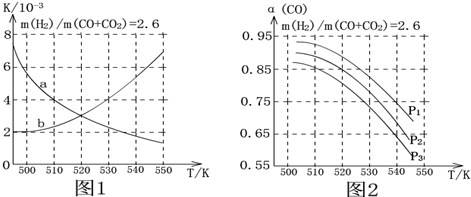
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示.α(CO)值随温度升高而减小(填“增大”或“减小”)原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小..图2中的压强由大到小为P1>P2>P3,判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高..
①CO(g)+2H2(g)═CH3OH(g)△H1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
(1)已知
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)图1中能正确表现反应①的平衡常数K随温度变化关系的曲线为a(填曲线标记字母),判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.

(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示.α(CO)值随温度升高而减小(填“增大”或“减小”)原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小..图2中的压强由大到小为P1>P2>P3,判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高..

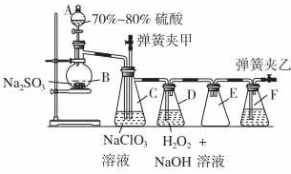 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠.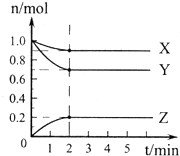 (1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y
(1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y 2Z.
2Z.