题目内容
【题目】工业上,向500—600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行试验。回答下列问题: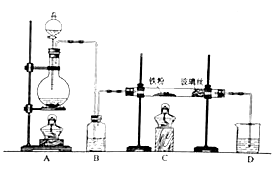
(1)制取无水氯化铁的实验中,A中反应的化学方程式为 , 装置B中加入的试剂是 。
(2)制取无水氯化亚铁的实验中,装置A用来制取。尾气的成分是 。若仍用D的装置进行尾气处理,存在的问题是。
(3)若操作不当,制得的FeCl2 , 会含有少量 FeCl3 , 检验FeCl2常用的试剂是 。欲制得纯净的FeCl2 , 在实验操作中应先 , 再 。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;浓硫酸; HCl;HCl和H2;发生倒吸、可燃性气体H2不能被吸收; KSCN溶液;点燃A处的酒精灯;点燃C处的酒精灯
MnCl2+Cl2↑+2H2O;浓硫酸; HCl;HCl和H2;发生倒吸、可燃性气体H2不能被吸收; KSCN溶液;点燃A处的酒精灯;点燃C处的酒精灯
【解析】(1)制取无水氯化铁白换验中,A装置为氯气的制备装置,发生的反应为二氧化锰和浓盐酸共热生成二氯化锰、氯气和水,反应的化学方程式为![]() (浓)
(浓)![]() +
+![]() ,装置B的作用是除去氯气中的水蒸气,B中加入的试剂是浓流酸,
,装置B的作用是除去氯气中的水蒸气,B中加入的试剂是浓流酸,
(2)根据题给信息知制取无水氯化亚铁的实验中,装置A用来制取HCl;尾气的成分是HCl和![]() ;若仍用D的装置进行尾气处理,氯化氢气体极易溶于水,氢气与氢氧化钠溶液不反应,则存在的问题是发生倒吸、可燃性气体
;若仍用D的装置进行尾气处理,氯化氢气体极易溶于水,氢气与氢氧化钠溶液不反应,则存在的问题是发生倒吸、可燃性气体![]() 不能被吸收;
不能被吸收;
(3)检验![]() 常用的试齐是KSCN溶液;欲制得纯净的
常用的试齐是KSCN溶液;欲制得纯净的![]() 。应防止装置中氧气的干扰,在实验操作中应先点燃A处的酒精灯,利用产生的氯化氢气体排出装置中的空气,再点燃C处的酒精灯。
。应防止装置中氧气的干扰,在实验操作中应先点燃A处的酒精灯,利用产生的氯化氢气体排出装置中的空气,再点燃C处的酒精灯。
【考点精析】利用弱电解质在水溶液中的电离平衡对题目进行判断即可得到答案,需要熟知当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.