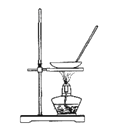
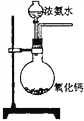
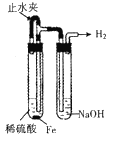
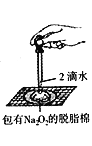
题目内容
【题目】[选修3—物质结构与性质]
(1)Ⅰ、下列物质的结构或性质与氢键无关的是( )
A.乙醚的沸点
B.乙醇在水中的溶解度
C.氢化镁的晶格能
D.DNA的双螺旋结构
(2)Ⅱ、钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。
回答下列问题:
(1)钒在元素周期表中的位置为 ,其价层电子排布图为 。
(2) 钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是 对,分子的立体构型为 ;SO3气态为单分子,该分子中S原子的杂化轨道类型为 ;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S—O键长由两类,一类键长约140pm,另一类键长约为160pm,较短的键为 (填图2中字母),该分子中含有 个σ键。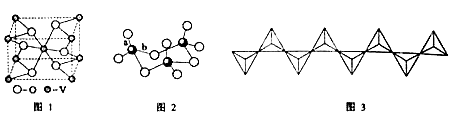
(4) V2O5溶解在NaOH溶液中,可得到钒酸钠(Na2VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为 。
【答案】
(1)A,C
(2)第4周期ⅤB族;![]() ;4;2;3;V形;sp2杂化;sp3杂化;a;12;正四面体形;NaVO3
;4;2;3;V形;sp2杂化;sp3杂化;a;12;正四面体形;NaVO3
【解析】
I、A、乙醚分子间不存在氢键,乙醚的沸点与氢键无关,正确;B,乙醇和水分子间能形成氢键,乙醇在水中的溶解度与氢键有关,错误;C,氢化镁为离子化合物,氢化镁白晶格能与氢键无关,正确;D,DNA的双螺旋结构涉及碱基配对,与氢键有关,错误,选AC。
II、(1)钒在元素周期表中的位置为第4周期第VB族,其价层电子排布式为![]() ,
,![]() 。
。
(2)分析钒的某种氧化物的晶胞结构利用切割法计算,晶胞中实际拥有的阴离子氧离子数目为4x1/2+2=4,阳离子钒离子个数为8x1/8+1=2。
(3)![]() 分子中S原子价电子排布式为
分子中S原子价电子排布式为![]() , 价层电子对数是3对,分子的立体构型V形;根据杂化轨道理论判断气态
, 价层电子对数是3对,分子的立体构型V形;根据杂化轨道理论判断气态![]() 单分子中S原子的杂化轨道类型为
单分子中S原子的杂化轨道类型为![]() 杂化;由
杂化;由![]() 的三聚体环状结构判断,该结构中S原子形成4个键,硫原子的杂化轨道类型为
的三聚体环状结构判断,该结构中S原子形成4个键,硫原子的杂化轨道类型为![]() 杂化;该结构中S-O键长两类,一类如图中a所示,含有双键的成分键能较大,键长较短,另一类为配位键,为单键,键能较小,键长较长;由题给结构分析该分子中含有12个
杂化;该结构中S-O键长两类,一类如图中a所示,含有双键的成分键能较大,键长较短,另一类为配位键,为单键,键能较小,键长较长;由题给结构分析该分子中含有12个![]() 键。
键。
(4)根据价层电子对互斥理论类断苷酸钠(![]() )中阴离子的立体构型为正四面体形;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式
)中阴离子的立体构型为正四面体形;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式![]() 。
。

【题目】根据题意填空
(1)写出H2C2O4与KMnO4酸性溶液反应的化学方程式.
(2)若要测定此反应的化学反应速率,最方便的测定方法是测定;
基于此,在实验时H2C2O4与KMnO4初始物质的量需要满足的关系为n(H2C2O4):n (KMnO4)≥ .
(3)为研究温度、浓度对此反应速率的影响,请完成以下表格
编号 | 0.1mol/L H2C2O4 溶液的体积/mL | 0.01mol/L 酸性 KMnO4 的体积/mL | 蒸馏水的体积/mL | 温度/℃ |
① | 2 | 4 | 2 | 25 |
② | 3 | |||
③ | 50 |