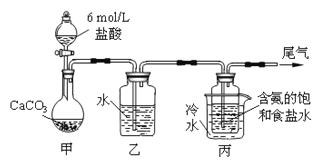
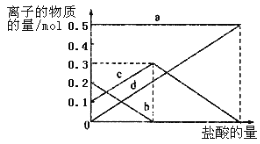
��Ŀ����
����Ŀ�����ֶ���������Ԫ��X��Y��Z��W��R��X��ԭ�Ӱ뾶�Ƕ���������Ԫ�������ģ�YԪ�� ��ԭ������������Ϊm������������Ϊn��ZԪ�ص�ԭ��L�������Ϊm+n��M�������Ϊm-n��WԪ����ZԪ��ͬ���壬RԪ����YԪ��ͬ���塣���������������
A. 60gZY2�к���2molZ-Y���Թ��ۼ�
B. Y���⻯���R���⻯���ȶ����۷е��
C. Z��W��R����������Ӧˮ���������ǿ��˳���ǣ�R>W>Z
D. X��Y�γɵ����ֳ��������������������ӵĸ����Ⱦ�Ϊ1��2
���𰸡�A
��������������������ֶ���������Ԫ��X��Y��Z��W��R��X��ԭ�Ӱ뾶�ڶ���������Ԫ���������XΪNaԪ�أ�YԪ�ص�ԭ����������Ϊm������������Ϊn��ZԪ�ص�ԭ��L�������Ϊm+n��M�������Ϊm-n����ΪL��������Ϊ8����n=2��m=6������YΪOԪ�أ�ZΪSiԪ�أ�WԪ����ZԪ��ͬ���壬��WΪCԪ�أ�RԪ����YԪ��ͬ���壬��RΪSԪ�ء�A��SiO2����ԭ�Ӿ��壬ÿ��Siԭ���γ�4��Si-O����60 g SiO2�����ʵ���Ϊ![]() =1mol������4 mol S-O���Թ��ۼ�����A����B��Y��R���⻯��ֱ�Ϊˮ�����⣬�ǽ�����O��S����ˮ���ȶ��Ա������ǿ��ˮ����֮�����������е�������⣬��B��ȷ��C���ǽ�����Z(Si)��W(C)��R(S)��������������Ӧˮ���������ǿ��˳���ǣ����̼����ᣬ��C��ȷ��D��X��Y�γɵ����ֳ���������Ϊ�����ơ��������ƣ����ߺ��е����������ӵĸ����Ⱦ�Ϊ1��2����D��ȷ����ѡA��
=1mol������4 mol S-O���Թ��ۼ�����A����B��Y��R���⻯��ֱ�Ϊˮ�����⣬�ǽ�����O��S����ˮ���ȶ��Ա������ǿ��ˮ����֮�����������е�������⣬��B��ȷ��C���ǽ�����Z(Si)��W(C)��R(S)��������������Ӧˮ���������ǿ��˳���ǣ����̼����ᣬ��C��ȷ��D��X��Y�γɵ����ֳ���������Ϊ�����ơ��������ƣ����ߺ��е����������ӵĸ����Ⱦ�Ϊ1��2����D��ȷ����ѡA��