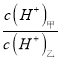题目内容
【题目】根据表中信息,判断以下叙述正确的是 ( )

A. 氢化物的稳定性为H2T<H2R
B. 单质与稀盐酸反应的速率为L>Q
C. L与M的最高价氧化物的水化物的碱性L<M
D. L2+ 与R2- 的核外电子数相等
【答案】B
【解析】短周期元素,T、R都有-2价,处于ⅥA族,T只有-2价,则T为O元素、R为S元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg元素,Q为Be元素,M有+3价,处于ⅢA族,原子半径M的介于L、R之间,则M为Al元素;A.非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,故A错误;B.金属性Mg>Be,则Mg与酸反应越剧烈,故B正确;C.NaOH的碱性比Al(OH)3强,故C错误;D.L2+的核外电子数为12-2=10,R2-的核外电子数为16-(-2)=18,不相等,故D错误,故选B。

练习册系列答案
相关题目