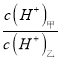题目内容
【题目】在同温同压下,A容器中的氧气和B容器中的氨所含的原子个数相同时,则A,B两容器中气体体积之比为( )
A.1:2
B.2:1
C.2:3
D.3:2
【答案】B
【解析】同温同压下,气体摩尔体积Vm相等,A容器中的氧气(O2)和B容器中的氨气(NH3)所含的原子个数相同,
由N=n×NA可知:2n(O2)=4n(NH3),
则n(O2):n(NH3)=2:1,
根据V=n×Vm可知,V(O2):V(NH3)=2Vm:Vm=2:1,
故答案为:B.
根据同温同压下,含有相同原子数判断两种气体的物质的量关系,结合阿伏伽德罗定律计算气体体积之比即可.

练习册系列答案
相关题目