题目内容
【题目】
(1)电子工业常用FeCl3溶液做腐蚀液制造印刷电路板。用FeCl3做腐蚀液与Cu反应的原理为:2FeCl3+Cu=2FeCl2+CuCl2将一定量铁粉和铜粉的混合物放入等浓度的FeCl3和CuCl2的混合溶液中,可发生多个反应,其中首先发生反应的离子方程式为:。
(2)某校研究性学习小组用已生锈(Fe2O3)的废铁屑制作印刷电路板的腐蚀液(FeCl3溶液),并将刻蚀电路板后的废液再生为FeCl3溶液循环使用。实验流程如下: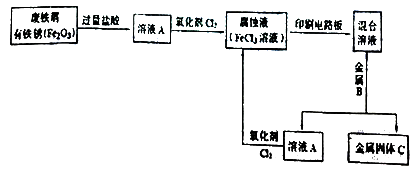
请根据使用流程写出下列反应的离子方程式:
溶液A→腐蚀液:。
混合溶液+金属B→金属固体C:。
(3)检验腐蚀液中Fe3+存在的常用试剂是 , 证明Fe3+存在的现象是。
(4)取适量混合溶液于试管中,加入一定量的铁粉,若反应结束后试管中仍有少量固体,则固体中一定含有 , 溶液中可能含有的金属阳离子是。
【答案】
(1)Fe+2Fe3+=3Fe2+
(2)2Fe2++Cl2=2Fe3++2Cl-;Fe+Cu2+=Cu+ Fe2+
(3)KSCN溶液;呈现血红色
(4)Cu;Cu2+
【解析】(1)由于氧化性Fe3+>Cu2+ , 还原性Fe>Cu,故先发生反应Fe+2Fe3+=3Fe2+;
由流程可知盐酸溶解铁和氧化铁,溶液A中通入氯气将溶液中的氯化亚铁氧化为氯化铁。腐蚀液和铜反应生成氯化铜和氯化亚铁,加入铁粉溶液中的铜离子置换出来,C是铁和铜的混合物。剩余溶液中通入氯气又转化为氯化铁。
(2)根据以上分析可知溶液A→腐蚀液的方程式为2Fe2++Cl2=2Fe3++2Cl-。混合溶液+金属B→金属固体C的方程式为Fe+Cu2+=Cu+ Fe2+ 。
(3)检验腐蚀液中Fe3+存在的常用试剂是KSCN溶液,证明Fe3+存在的现象是溶液呈现血红色。
(4)混合溶液中一定含有氯化铜和氯化亚铁,可能含有氯化铁,因此取适量混合溶液于试管中,加入一定量的铁粉,若反应结束后试管中仍有少量固体,则固体中一定含有铜,溶液中可能含有的金属阳离子是铜离子。
根据铁离子、铜离子的氧化性强弱分析铁和铜在溶液中的反应,结合铁离子的检验方法进行回答即可。