题目内容
【题目】已知反应:COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=+7 kJ/mol
H2S(g)+CO(g) ΔH1=+7 kJ/mol
COS(g)+H2O(g)![]() H2S (g)+CO2(g) ΔH2=-35 kJ/mol
H2S (g)+CO2(g) ΔH2=-35 kJ/mol
则热化学方程式:CO(g)+H2O (g)![]() H2(g)+CO2(g) ΔH3,则ΔH3为
H2(g)+CO2(g) ΔH3,则ΔH3为
A.-42kJ/molB.-28kJ/molC.+42kJ/molD.+28kJ/mol
【答案】A
【解析】
①COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=+7 kJ/mol
H2S(g)+CO(g) ΔH1=+7 kJ/mol
②COS(g)+H2O(g)![]() H2S (g)+CO2(g) ΔH2=-35 kJ/mol
H2S (g)+CO2(g) ΔH2=-35 kJ/mol
根据盖斯定律,②-①,整理可得CO(g)+H2O (g)![]() H2(g)+CO2(g) ΔH3=-42kJ/mol,故合理选项是A。
H2(g)+CO2(g) ΔH3=-42kJ/mol,故合理选项是A。

【题目】下列方案设计能达到实验目的的是
A | B | C | D |
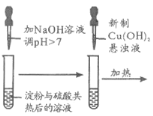
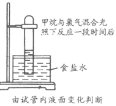
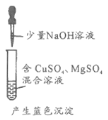
检验淀粉是否水解 | 由褪色快慢研究反应物浓度对反应速率的影响 | 证明发生了取代反应 | 验证Ksp[Cu(OH)2]<Ksp[Mg(OH)2 ] |
|
|
|
|
A.AB.BC.CD.D
【题目】硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:
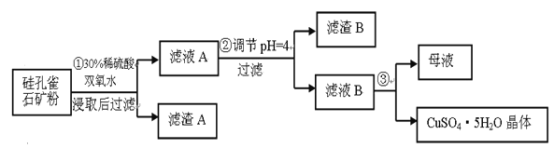
(1)完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4+_______+H2O;双氧水的作用是_________________。
(2)步骤②调节溶液pH,可以选用的试剂是______。
A.CuO | B.Fe2O3 | C.Al2O3 | D.Cu(OH)2 |
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为_____,滤液B中除Cu2+外, 还含有的金属阳离子是_______。
(4)将滤液B通过________、_______,过滤等操作可得到硫酸铜晶体。
(5)测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果____(填“偏高”、“偏低”或“不变”)。