题目内容
18.原子序数依次增大的四种短周期元素X、Y、Z、W,X与Z同主族且X最外层电子比次外层电子多2个,Y元素的周期序数等于族序数,W元素的最高正价与最低负价代数和为4,下列说法错误的是( )| A. | 最高价氧化物对应水化物的酸性:W>X>Z>Y | |
| B. | 氢化物的稳定性:X>Z | |
| C. | Y单质可用于钢轨的焊接 | |
| D. | 原子半径大小顺序:X<Y<Z<W |
分析 X最外层电子比次外层电子多2个,应为C元素,X与Z同主族,Z为Si元素,Y元素的周期序数等于族序数,为Al元素,W元素的最高正价与最低负价代数和为4,W为S元素,结合元素周期率知识解答该题.
解答 解:X最外层电子比次外层电子多2个,应为C元素,X与Z同主族,Z为Si元素,Y元素的周期序数等于族序数,为Al元素,W元素的最高正价与最低负价代数和为4,W为S元素,
A.非金属性S>C>Si>Al,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,故A正确;
B.非金属性C>Si,元素的非金属性越强,对应的氢化物的稳定性越强,故B正确;
C.Y为Al,活泼性比铁强,可用于钢轨的焊接,故C正确;
D.原子半径大小顺序为C<S<Si<Al,故D错误.
故选D.
点评 本题考查结构性质位置关系应用,为高频考点,侧重于学生的分析能力的考查,推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
8.同周期的X,Y和Z三种元素,已知关系如下:HXO4,H2YO4和H3ZO4的酸性依次减弱,下列判断不正确的是( )
| A. | 非金属性:X最强,Z最弱 | |
| B. | 原子半径:X最大,Z最小 | |
| C. | 气态氢化物稳定性:HX最强 | |
| D. | 气态氢化物水溶液酸性:ZH3<H2Y<HX |
9.下列各组溶液同时开始混合,哪组最先出现浑浊( )
| A. | 10℃,5mL0.1mol•L-1Na2S2O3(aq)+5mL0.1mol•L-1 H2SO4(aq) | |
| B. | 10℃,10mL0.05mol•L-1 Na2S2O3 (aq)+10mL0.1mol•L-1H2SO4(aq) | |
| C. | 20℃,5mL0.1mol•L-1 Na2S2O3(aq)+5mL0.1mol•L-1 H2SO4(aq) | |
| D. | 20℃,10mL0.05mol•L-1 Na2S2O3(aq)+10mL0.05mol•L-1H2SO4(aq) |
6.根据碘与氢气反应的化学方程式(其中“+”表示放出热量):(Ⅰ)I2(g)+H2(g)?2HI(g)+9.48kJ;(Ⅱ)I2(s)+H2(g)?2HI(g)-26.48kJ.下列判断正确的是( )
| A. | 254gI2(g)中通入2gH2(g),反应放热9.48kJ | |
| B. | 反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定 | |
| C. | 反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低 | |
| D. | 1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
13.氨甲环酸和氨甲苯酸是临床上常用的止血药,其结构如图.下列说法正确的是( )
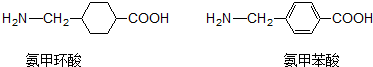
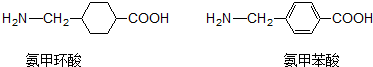
| A. | 氨甲环酸、氨甲苯酸都能发生取代、氧化、加聚、加成等反应 | |
| B. | 氨甲环酸、氨甲苯酸中都有5种不同的氢原子 | |
| C. | 氨甲环酸与氨甲苯酸互为同分异构体 | |
| D. | 氨甲环酸、氨甲苯酸都能与NaOH溶液反应 |
3.如果12C原子的原子量改为24,则下列各项不发生改变的是( )
| A. | 阿伏加德罗常数 | |
| B. | 标准状况下气体摩尔体积 | |
| C. | 一定质量氢气所含的氢气的分子个数 | |
| D. | 溶液的物质的量的浓度 |
7.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C $\stackrel{高温}{?}$2AlN+3CO下列叙述正确的是( )
| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂 | |
| B. | 上述反应中每生成2molAlN,N失去6mol电子 | |
| C. | 氮化铝中氮元素的化合价为-3 | |
| D. | 氮化铝的摩尔质量为41g/mol |
8.某温下,KW=10a,M(OH)2(s)?M2+(aq)+2OH-(aq) Ksp=b.当存在M(OH)2(s) 且c(M2+)=c mol•L-1时,溶液的pH等于( )
| A. | $\frac{1}{2}$(lgc-lgb) | B. | $\frac{1}{2}$(lgb-lgc) | C. | $\frac{1}{2}$(lgb-lgc)-a | D. | $\frac{1}{2}$(lgc-lgb)-a |