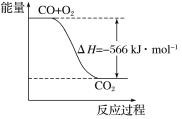
题目内容
【题目】下列实验目的、装置、现象及对应发生反应的方程式均正确的是
选项 | 目的 | 装置 | 现象 | 方程式 |
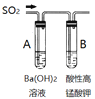
A | 验证SO2性质 |
| A中出现浑浊; B中颜色变浅 | A:SO2+Ba2++2OH-=BaSO3↓+H2O B:5SO2+2H2O+2MnO4— =5SO42—+2Mn2++4H+ |
B | 鉴别Br2(g)与NO2(g) |
| 通NO2所得溶液无色;通Br2所得溶液呈黄色 | 3NO2+H2O=2HNO3+NO Br2+H2O=2H++Br-+BrO- |
C | 检验Fe3+ |
| 滴加铁氰化钾溶液,产生蓝色沉淀 | 2Fe3++3[Fe(CN)4]2-=Fe2[Fe(CN)4]3↓ |
D | 探究浓度对反应速率的影响 |
| 注射器中收集到气体,测定收集一定体积气体所需时间 | Zn+H2SO4=ZnSO4+H2↑ |
A. A B. B C. C D. D
【答案】A
【解析】
A、为验证二氧化硫为酸性氧化物,将其通入氢氧化钡溶液中,出现浑浊,发生反应SO2+Ba2++2OH-=BaSO3↓+H2O;为验证二氧化硫的还原性,将其通入酸性高锰酸钾溶液中,溶液颜色变浅,发生反应5SO2+2H2O+2MnO4—=5SO42—+2Mn2++4H+;选项A正确;
B、NO2(g)通入水中,生成HNO3,溶液无色:3NO2+H2O═2HNO3+NO;Br2(g)通入水中,得到溴水,溴不能完全溶解颜色呈黄色:Br2+H2O![]() H++Br-+HBrO,选项B错误;
H++Br-+HBrO,选项B错误;
C、检验Fe3+,应滴加KSCN溶液,溶液变为血红色:Fe3++SCN-=Fe (CCN) 3;若检验Fe2+,才是滴加铁氰化钾溶液,产生蓝色沉淀:2Fe3++3[Fe(CN)4]2-=Fe2[Fe(CN)4]3↓;选项C错误;
D、实验用长颈漏斗加入稀硫酸与锌粒反应制取氢气,没有液封,实验失败,应改用分液漏斗,且实验中没有计时器和不同浓度的硫酸溶液,无法探究浓度对反应速率的影响,选项D错误。
答案选A。

 中考解读考点精练系列答案
中考解读考点精练系列答案