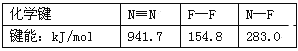题目内容
【题目】在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g) ![]() 2NH3(g) △H<0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是( )
2NH3(g) △H<0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是( )
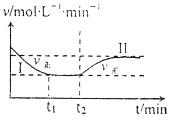
A.I、II两过程达到平衡时,平衡常数:KI<KII
B.I、II两过程达到平衡时,NH3的体积分数:I<II
C.I、II两过程达到平衡的标志:气体密度不再发生变化
D.t2时刻改变的条件可以是向密闭容器中加H2和N2混合气
【答案】B
【解析】
试题分析:A.在一恒温恒容的密闭容器中进行同一反应,由于t2时逆反应速率增大,说明是使用了催化剂,由于催化剂不能使化学平衡发生移动,化学平衡常数只与温度有关,温度不变,化学平衡常数不变,所以化学平衡常数:KI=KII,错误;B.由于II过程达到平衡后逆反应速率大于正反应速率,化学平衡逆向移动,当达到平衡时逆反应速率小于开始时的正反应速率,所以平衡时其中NH3的体积分数:I<II,正确;C.由于容器的容积不变,反应混合物都是气体,所以在任何时刻气体的密度都不变,故I、II两过程不能根据气体密度是否改变判断反应是否达到平衡状态,错误;D.若t2时刻改变的条件是向密闭容器中加H2和N2混合气,则反应的正反应速率应该突然增大,逆反应速率不变,这与图像无吻合,错误。

练习册系列答案
相关题目
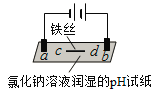
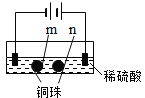
【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;…… |
下列对实验现象的解释或推测不合理的是( )
A.a、d处:2H2O+2e-=H2↑+2OH-
B.b处:2Cl--2e-=Cl2↑
C.c处发生了反应:Fe-2e-=Fe2+
D.根据实验一的原理,实验二中m处能析出铜