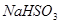题目内容
(18分)某校化学兴趣小组为研究Cu与浓硫酸反应并制备少量硫酸铜,进行如下实验。
该小组同学在实验中发现使用教材所提供的铜和浓硫酸反应的实验装置不仅安全性差而且易造成环境污染。经过同学们的讨论以及老师的指导,该小组设计了如图所示的装置并进行实验。

请回答:
(1)请写出长导管B的作用 (只写一点就可);
(2)写出检查该装置气密性的方法 。
(3)D、E试管中CCl4的作用 。
(4)写出A中发生反应的化学方程式并标出电子转移的方向与数目
(5)对试管A进行加热,发现E试管中有气泡逸出,品红溶液很快褪色,但最终未见D试管中氢氧化钡溶液出现浑浊,为探究D试管中未出现浑浊的原因,该小组同学在化学手册中只查阅到下列物质常温下的溶解度数据:
请你应用类比研究方法帮他们预测D试管未出现浑浊的原因: 。
(6)为验证D试管中溶液的组成,进行了下列实验,请你帮助完成下列实验报告:
该小组同学在实验中发现使用教材所提供的铜和浓硫酸反应的实验装置不仅安全性差而且易造成环境污染。经过同学们的讨论以及老师的指导,该小组设计了如图所示的装置并进行实验。

请回答:
(1)请写出长导管B的作用 (只写一点就可);
(2)写出检查该装置气密性的方法 。
(3)D、E试管中CCl4的作用 。
(4)写出A中发生反应的化学方程式并标出电子转移的方向与数目
(5)对试管A进行加热,发现E试管中有气泡逸出,品红溶液很快褪色,但最终未见D试管中氢氧化钡溶液出现浑浊,为探究D试管中未出现浑浊的原因,该小组同学在化学手册中只查阅到下列物质常温下的溶解度数据:
| 物质 | 溶解度(g/100水) | 物质 | 溶解度(g/100水) |
| Ca(OH)2 | 0.173 | Ba(OH)2 | 3.89 |
| CaCO3 | 0.0013 | BaSO3 | 0.016 |
| Ca(HCO3)2 | 16.60 | | |
(6)为验证D试管中溶液的组成,进行了下列实验,请你帮助完成下列实验报告:
| 实验方案 | 现象 |
| 方案1:取少量溶液于试管中,加入稀盐酸,加热,用①检验产生的气体。 | ② |
| 方案2:取少量溶液于试管中,加入③ 溶液并观察现象。 | ④ |
(18分)(1)平衡压强,防止C中液体倒吸或防堵塞或反应结束通入N2排出SO2,防污染 (只写一点就可);
(2)在A、E中分别加入适量的水至浸没导气管,如图连好装置,微热试管A ,若E中有气泡出现,且停止加热后E中导气管中有一段水柱,则气密性良好。
(3)防倒吸 (4) (或双线桥法)
(或双线桥法)
(5)生成了溶解度较大的Ba(HSO3)2(6)(答案合理即给分)
① 湿润的品红试纸 ②试管中有气泡产生,品红试纸褪色 ③ NaOH溶液 ④溶液变浑浊
(2)在A、E中分别加入适量的水至浸没导气管,如图连好装置,微热试管A ,若E中有气泡出现,且停止加热后E中导气管中有一段水柱,则气密性良好。
(3)防倒吸 (4)
 (或双线桥法)
(或双线桥法)(5)生成了溶解度较大的Ba(HSO3)2(6)(答案合理即给分)
① 湿润的品红试纸 ②试管中有气泡产生,品红试纸褪色 ③ NaOH溶液 ④溶液变浑浊
)(1)根据装置图可知B的主要有平衡压强,防止C中液体倒吸或防堵塞或反应结束通入N2排出SO2,防污染。
(2)根据装置的特点可知,检查该装置气密性的方法是在A、E中分别加入适量的水至浸没导气管,如图连好装置,微热试管A ,若E中有气泡出现,且停止加热后E中导气管中有一段水柱,则气密性良好。
(3)由于SO2易溶于水,而难溶在四氯化碳中,且四氯化碳被溶于水,所以主要可以防止倒吸。
(4)浓硫酸和铜的反应中,硫酸是氧化剂,铜是还原剂,转移2个电子,所以反应的方程式是 。
。
(5)根据已知碳酸钙和碳酸氢钙的溶解度可知,应该是生成了溶解度较大的Ba(HSO3)2,所以得不到白色沉淀亚硫酸钡。
(6)亚硫酸盐和盐酸反应生成SO2,所以检验的方法是用湿润的品红试纸,现象是试管中有气泡产生,品红试纸褪色;亚硫酸钡能和氢氧化钠反应生成白色沉淀亚硫酸钡,所以加入的试剂是氢氧化钠溶液,而现象是溶液变浑浊。
(2)根据装置的特点可知,检查该装置气密性的方法是在A、E中分别加入适量的水至浸没导气管,如图连好装置,微热试管A ,若E中有气泡出现,且停止加热后E中导气管中有一段水柱,则气密性良好。
(3)由于SO2易溶于水,而难溶在四氯化碳中,且四氯化碳被溶于水,所以主要可以防止倒吸。
(4)浓硫酸和铜的反应中,硫酸是氧化剂,铜是还原剂,转移2个电子,所以反应的方程式是
 。
。(5)根据已知碳酸钙和碳酸氢钙的溶解度可知,应该是生成了溶解度较大的Ba(HSO3)2,所以得不到白色沉淀亚硫酸钡。
(6)亚硫酸盐和盐酸反应生成SO2,所以检验的方法是用湿润的品红试纸,现象是试管中有气泡产生,品红试纸褪色;亚硫酸钡能和氢氧化钠反应生成白色沉淀亚硫酸钡,所以加入的试剂是氢氧化钠溶液,而现象是溶液变浑浊。

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
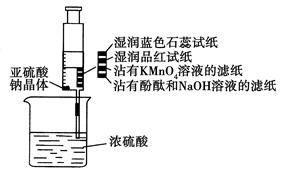
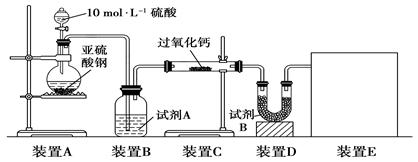

 和
和 的反应,用类比的方法推理
的反应,用类比的方法推理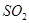 反应的固体产物为__________。另一部分同学依据
反应的固体产物为__________。另一部分同学依据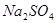 。为检验生成物中是否存在
。为检验生成物中是否存在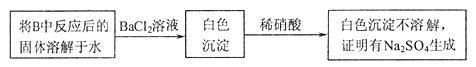
 溶液中缓慢通入
溶液中缓慢通入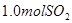 气体,请分析通入
气体,请分析通入 的范围
的范围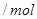
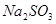 、
、