题目内容
【题目】醇与氢卤酸的反应是制备卤代烃的重要方法,实验室制备溴乙烷和1—溴丁烷的反应如下:NaBr+H2SO4(浓)=HBr+NaHSO4R-OH+HBr→R-Br+H2O
可能存在的副反应有:醇在浓硫酸的作用下脱水生成烯烃和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
乙醇 | 溴乙烷 | 正丁醇 | 1—溴丁烷 | |
密度/g.cm-3 | 0.79 | 1.46 | 0.81 | 1.28 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
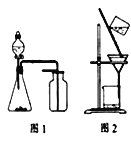
(1)溴乙烷和1—溴丁烷的制备过程中,下列仪器最不可能用到的是(______)
A.圆底烧瓶 B.量筒 C.锥形瓶 D.漏斗
(2)卤代烃的水溶性__(填“大于”、“小于”或者“等于”)相应的醇,其原因是__。
(3)将溴乙烷粗产品置于分液漏斗中加水,震荡后静置,产品在__(填“上层”、“下层”或者“不分层”)。
(4)在制备溴乙烷时,乙醇会在浓硫酸的作用下脱水生成醚,写出此反应的化学方程式__。
(5)制备操作中,加入的浓硫酸必须稀释,其原因是(______)
A.减少副产物烯烃和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂
(6)欲除去卤代烃中的少量杂质Br2,下列物质中最适合的是(______)
A.NaI B.NaOH C.NaHSO3 D.KCl
【答案】D 小于 醇分子和水分子间可形成氢键,卤代烃分子和水分子间不能形成氢键 下层 2CH3CH2OH ![]() CH3CH2OCH2CH3+H2O ABC C
CH3CH2OCH2CH3+H2O ABC C
【解析】
(1)过滤操作时用到漏斗,故在溴乙烷和1—溴丁烷的制备实验中,最不可能用到的仪器
是漏斗;
(2)醇分子中含有羟基,醇与水分子之间可以形成氢键,故醇易溶于水;
(3)溴乙烷与水互不相溶,并且溴乙烷的密度比水的密度大;
(4)在制备溴乙烷时,乙醇会在浓硫酸的作用下,乙醇分子间脱水生成乙醚;
(5)浓硫酸具有强氧化性,能把Br-氧化成Br2;浓硫酸具有脱水性和吸水性,一定温度下,乙醇在浓硫酸的作用下能发生消去反应,浓硫酸溶解在溶液中放出大量的热,容易使溴化氢挥发;
(6)根据卤代烃在碱性溶液中水解,NaI和Br2反应生成I2,KCl与Br2不反应。
(1)A.圆底烧瓶可作为反应容器,是可用到的仪器,A不符合题意;
B.量筒可用来量取反应物,是可用到的仪器,B不符合题意;
C.锥形瓶可作为反应容器,是可用到的仪器,C不符合题意;
D.实验中无需过滤,所以最不可用到的仪器是漏斗, D符合题意;
答案选D;
(2)醇是能和水分子间形成氢键的物质而易溶于水,卤代烃和水不反应也不能和水形成氢键,所以卤代烃的水溶性小于相应的醇;
(3)溴乙烷与水互不相溶,并且溴乙烷的密度比水的密度大,所以将溴乙烷粗产品置于分液漏斗中加水,震荡后静置,产品在下层;
(4)在制备溴乙烷时,乙醇会在浓硫酸的作用下,乙醇分子间脱水生成乙醚,反应方程式为2CH3CH2OH ![]() CH3CH2OCH2CH3+H2O;
CH3CH2OCH2CH3+H2O;
(5)A.醇在浓硫酸作用下发生副反应,发生消去反应生成烯烃、分子间脱水生成醚,稀释后不能发生类似的反应,减少副产物烯烃和醚的生成,A正确;
B.浓硫酸具有强氧化性,能把Br-氧化成Br2,稀释浓硫酸后能减少Br2的生成,B正确;
C.反应需要溴化氢和乙醇或1—丁醇反应,浓硫酸溶解温度升高,使溴化氢挥发,稀释后减少溴化氢的挥发,C正确;
D.水是产物,不是催化剂,D错误;
答案选ABC;
(6)A.NaI和Br2反应生成I2,但生成的I2会混入卤代烃中,A不适合;
B.Br2和NaOH反应,卤代烃在氢氧化钠溶液中发生水解,B不适合;
C.Br2和NaHSO3溶液发生氧化还原反应,可以除去Br2,C适合;
D.KCl不能除去Br2,D不适合;
答案选C。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案