题目内容
【题目】空气质量与我们的健康息息相关,目前我国通过监测 6 项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2 和 CO 是其中 3 项中的污染物。
(1)一定温度下,向固定体积为 2 L 的密闭容器中充入 SO2 和 NO2 各 1 mol,发生反应SO2(g)+NO2(g) ![]() SO3(g)+NO(g),测得上述反应 5 min 末到达平衡,此时容器中 NO 与 NO2的体积比为 3︰1,则这段时间内 SO2 的反应速率 v(SO2)=__________,此反应在该温度下的平衡常数 K=__________。
SO3(g)+NO(g),测得上述反应 5 min 末到达平衡,此时容器中 NO 与 NO2的体积比为 3︰1,则这段时间内 SO2 的反应速率 v(SO2)=__________,此反应在该温度下的平衡常数 K=__________。
(2)甲醇日趋成为重要的有机燃料,通常利用 CO 和 H2 合成甲醇,其反应的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g)。今在一容积可变的密闭容器中,充有 10 mol CO 和 20 mol H2用于合成甲醇。CO 的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有 10 mol CO 和 20 mol H2用于合成甲醇。CO 的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:

①上述合成甲醇的反应为__________反应(填“放热”或“吸热”)。
②A、B、C 三点的平衡常数 KA、KB、KC 的大小关系为__________。A、B 两点对应的压强大小关系是 PA__________PB(填“大于”、 “小于”或“等于”)。
(3) 若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为____________,理论上通过外电路的电子最多为__________mol。
【答案】0.075mol/(Lmin) 9 放热 KA=KB>KC 小于 O2+2H2O+4e-=4OH- 30
【解析】
(1)设参加反应的SO2为nmol
SO2(g)+NO2(g) ![]() SO3(g)+NO(g)
SO3(g)+NO(g)
反应前(mol) 1 10 0
反应了(mol) nn n n
5min末(mol) 1-n 1-n nn
可以此计算相关量;
(2)①化学平衡图象分析方法,平衡图象题主要注意三点一趋势,三点是:图象的起点、拐点、终点,一趋势是看曲线的变化趋势.当然要看好横、纵坐标的向量;
②对于一个给定的化学反应,化学平衡常数的影响因素只有温度;
③碱性条件下,正极发生还原反应生成OH-。
(1)设参加反应的SO2为nmol
SO2(g)+NO2(g) ![]() SO3(g)+NO(g)
SO3(g)+NO(g)
反应前(mol) 1 10 0
反应了(mol) nn n n
5min末(mol) 1-n 1-n nn
![]() =3可求得:n=0.75,v(SO2)=
=3可求得:n=0.75,v(SO2)= 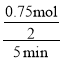 =0.075mol/(Lmin)因其体积是2L,求出各自的浓度代入可求K,K=
=0.075mol/(Lmin)因其体积是2L,求出各自的浓度代入可求K,K= ![]() =9,故答案为:0.075mol/(Lmin);9;
=9,故答案为:0.075mol/(Lmin);9;
(2)①从图上可见,在P2时,随温度的升高CO的转化率越来越低,可见,升温时平衡向逆向移动,据勒夏特列原理,正反应放热,故答案为:放热;
②化学平衡常数只受温度的影响,该反应放热,温度越高平衡逆向移动,K值减小,增大压强,平衡正向移动,CO的转化率增大,可知PA小于PB,故答案为:KA=KB>KC;小于;
③燃料电池的正极,是氧气反应,在碱性条件下有水参与生成氢氧根,O2+2H2O+4e-=4OH-,A点CO的平衡转化率50%,参加反应的CO为:10mol×50%=5mol,从CO(g)+2H2(g) ![]() CH3OH(g)分析,生成CH3OH也为5mol,CH3OH燃烧生成二氧化碳和水,只有C的价态从-2变为+4,H、O价态没变,所以1molCH3OH燃烧转移6mol电子,故5molCH3OH反应转移电子为:5×6=30,故答案为:O2+2H2O+4e-=4OH-;30。
CH3OH(g)分析,生成CH3OH也为5mol,CH3OH燃烧生成二氧化碳和水,只有C的价态从-2变为+4,H、O价态没变,所以1molCH3OH燃烧转移6mol电子,故5molCH3OH反应转移电子为:5×6=30,故答案为:O2+2H2O+4e-=4OH-;30。

【题目】已知![]() 下,下列酸的电离常数如下:
下,下列酸的电离常数如下:
化学式 |
| HCN |
|
电离常数 |
|
|
|
下列各项不正确的是![]()
A.往NaCN溶液中通入少量![]() :
:![]()
B.往碳酸钠溶液中加足量醋酸:![]()
C.多元弱酸的酸性由第一步电离决定,因为第一步电离产生的氢离子对下一步电离起抑制作用
D.等物质的量浓度的![]() 和NaCN溶液,NaCN溶液的碱性更强
和NaCN溶液,NaCN溶液的碱性更强
【题目】对如表实验现象或操作的解释或结论错误的是![]()
编号 | 现象或操作 | 解释或结论 |
A | KI淀粉溶液中滴入氯水变蓝,再通入 |
|
B | 在 | 盐类水解反应是吸热反应 |
C | 向少量火柴头的浸泡溶液中滴加 | 火柴头里含有氯元素 |
D | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是馏出物的沸点 |
A.AB.BC.CD.D
