题目内容
【题目】碳、硫的含量影响钢铁性能.碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定.
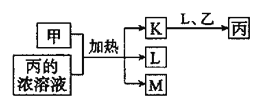
(1)采用如图装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2.
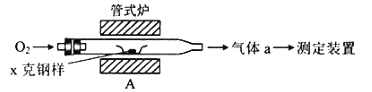
①气体a的成分是_____.
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2![]() 1_____+3_____.
1_____+3_____.
(2)将气体a通入测硫酸装置中(如图),采用滴定法测定硫的含量.
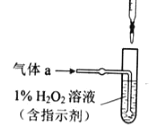
①H2O2氧化SO2的化学方程式:_____
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液.若消耗1mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:_____.
(3)将气体a通入测碳装置中(如图),采用重量法测定碳的含量.
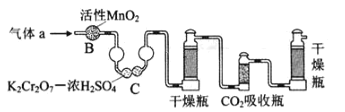
①气体a通过B和C的目的是_____
②计算钢样中碳的质量分数,应测量的数据是_____.
【答案】CO2、SO2、O2 Fe3O4 SO2 H2O2+SO2=H2SO4 ![]() 除去SO2对CO2测定的干扰 吸收CO2气体前后吸收瓶的质量
除去SO2对CO2测定的干扰 吸收CO2气体前后吸收瓶的质量
【解析】
(1)①该装置中C、S和氧气反应生成二氧化碳、二氧化硫,还有部分氧气剩余;
②若钢样中S以FeS形式存在,FeS被氧气氧化,Fe元素化合价由+2价变为+3价,-2价的S被氧化为+4价,结合化学计量数知,生成物是二氧化硫和四氧化三铁;
(2)①双氧水具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸;
②若消耗1mL NaOH溶液相当于硫的质量为y克,z mL NaOH溶液相当于硫的质量为yzg,再根据质量分数公式计算硫的质量分数;
(3)①测定二氧化碳的含量,需要将二氧化硫除去防止造成干扰;
②计算钢样中碳的质量分数,需要测定吸收二氧化碳的质量。
(1)①钢样中的碳、硫在装置A中被氧化为CO2、SO2,故a的成分为CO2、SO2以及未反应的O2;
②FeS中的-2价的硫被氧化为SO2,+2价的Fe被氧化为+3价的铁,结合所给化学计量数,可知产物应为Fe3O4和SO2,故方程式为3FeS+5O2![]() Fe3O4+3SO2;
Fe3O4+3SO2;
(2)①H2O2具有氧化性,可氧化SO2使S的化合价升高为+6价,在溶液中反应产物应为硫酸,故反应方程式为:H2O2+SO2=H2SO4;
②1mL NaOH相当于yg S,故z mL NaOH相当于zy g S,则该样品中硫的质量分数为![]() ;
;
(3)①测定碳的含量需将气体a中的SO2除去,防止造成干扰,B装置可氧化二氧化硫,C装置可以吸收二氧化硫,所以装置B和C的作用是氧化二氧化硫、除去二氧化硫,故装置B和C的作用是除去SO2;
②计算碳的质量分数须利用CO2的质量进行分析,故需测量CO2吸收瓶在吸收CO2气体前后的质量。