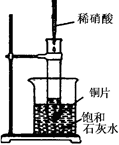
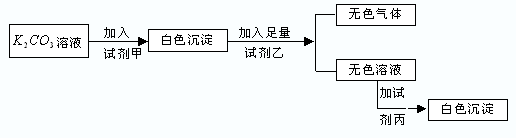
题目内容
“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或PH值控制可参考下列附表确定
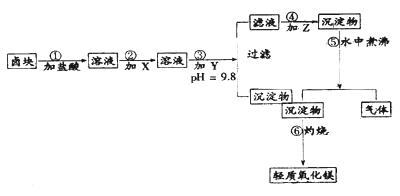
轻质氧化镁生产工艺流程图
表1 生成氢氧化物沉淀的PH值
*)注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常常将它氧化成为Fe3+,生成
Fe(OH)3沉淀而去除之。
表2 化学试剂价值表
请填写以下空白:
(1)在步骤②加入的试剂X,最佳选择应是 ,其作用是 。
(2)步骤③加入的试剂Y应是 ;之所以要控制pH=9.8,其目的是 。
(3)在步骤⑤时发生的化学反应方程式是:

轻质氧化镁生产工艺流程图
表1 生成氢氧化物沉淀的PH值
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 | 2.7 7.6 8.3 9.6 | 3.7 9.6 9.8 11.1 |
Fe(OH)3沉淀而去除之。
表2 化学试剂价值表
| 试剂 | 价格(元/t) |
| 漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) | 450 2400 2100 600 310 |
(1)在步骤②加入的试剂X,最佳选择应是 ,其作用是 。
(2)步骤③加入的试剂Y应是 ;之所以要控制pH=9.8,其目的是 。
(3)在步骤⑤时发生的化学反应方程式是:
(l)漂液,使Fe2+ Fe3+
Fe3+
(2)NaOH使杂质离子(Fe3+、Mn2+)沉淀完全又尽量减少Mg2+损失
(3)
 Fe3+
Fe3+(2)NaOH使杂质离子(Fe3+、Mn2+)沉淀完全又尽量减少Mg2+损失
(3)

在题目第一段阅读中要明确试题要求:(1)由卤块(含杂质的MgCl2)制得“轻质氧化镁”(不含杂质Fe2+、Fe3+、Mn2+离子)(2)成本较低。在阅读观察工艺流程图要明确:(3)杂质离子在步骤③加入Y(NaOH)强调PH=9.8除(成为 Fe(OH)3、Mn(OH)2沉淀)(4)步骤④、⑤、⑥是由MgCl2(含Na+)到轻质氧化镁的转化、制备过程。(3)通过逆向思维:MgO Mg(OH)2
Mg(OH)2 MgCO3。因此步骤③所得滤液中应加Z是Na2CO3(步骤④)所得沉淀物为MgCO3,经过步骤⑤在水中煮沸,MgCO3水解生成 Mg(OH)2,并放出CO2气体。
MgCO3。因此步骤③所得滤液中应加Z是Na2CO3(步骤④)所得沉淀物为MgCO3,经过步骤⑤在水中煮沸,MgCO3水解生成 Mg(OH)2,并放出CO2气体。
在阅读附表1时需结合试题分析(5)在步骤②需加氧化剂使Fe2+转化为Fe3+以便沉淀完全容易除去。(6)步骤③控制PH=9.8是为了使Mn(OH)2沉淀完全,虽然Mg(OH)2已开始沉淀会影响产率,但保证了产品纯度,且原料卤块价格比较低廉。(7)在阅读附表2时可以从成本较低的角度考虑步骤②
本题结合工业生产实际考查无机化合物(轻质氧化镁)的转化生成、分离、提纯问题。涉及了金属元素(Mg、Fe、Mn)及其化合物相互转化的知识和信息加工、迁移能力,逻辑推理和逆向思维能力。
 Mg(OH)2
Mg(OH)2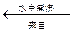 MgCO3。因此步骤③所得滤液中应加Z是Na2CO3(步骤④)所得沉淀物为MgCO3,经过步骤⑤在水中煮沸,MgCO3水解生成 Mg(OH)2,并放出CO2气体。
MgCO3。因此步骤③所得滤液中应加Z是Na2CO3(步骤④)所得沉淀物为MgCO3,经过步骤⑤在水中煮沸,MgCO3水解生成 Mg(OH)2,并放出CO2气体。在阅读附表1时需结合试题分析(5)在步骤②需加氧化剂使Fe2+转化为Fe3+以便沉淀完全容易除去。(6)步骤③控制PH=9.8是为了使Mn(OH)2沉淀完全,虽然Mg(OH)2已开始沉淀会影响产率,但保证了产品纯度,且原料卤块价格比较低廉。(7)在阅读附表2时可以从成本较低的角度考虑步骤②
本题结合工业生产实际考查无机化合物(轻质氧化镁)的转化生成、分离、提纯问题。涉及了金属元素(Mg、Fe、Mn)及其化合物相互转化的知识和信息加工、迁移能力,逻辑推理和逆向思维能力。

练习册系列答案
相关题目

 +6HCHO=3H++6H2O+(CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
+6HCHO=3H++6H2O+(CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验: