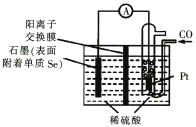
ЬтФПФкШн
ЁОЬтФПЁПЕтдкПЦбагыЩњЛюжагаживЊгІгУЁЃ
(1)I2O5 ЪЧАзЩЋЗлФЉзДЙЬЬхЃЌдкКЯГЩАБЙЄвЕжаГЃгУ I2O5 РДЖЈСПВтСП CO ЕФКЌСПЁЃ
вбжЊЃК2I2 (s)+5O2 (g)=2I2O5 (s) ЁїH=Љ75.56kJЁЄmol-1
2CO (g)+O2 (g)=2CO2 (g) ЁїH=Љ566.0kJЁЄmol-1
аДГі CO (g)гы I2O5 (s)ЗДгІЮіГіЙЬЬЌ I2 ЕФШШЛЏбЇЗНГЬЪНЃК_____ЃЌШєетИіЗДгІвЛЖЈФмздЗЂНјааЃЌдђЗДгІЕФЁїS_____0(ЬюЁА>ЁБЃЌЁА<ЁБЛђ ЁА=ЁБ)ЃЛ
(2)ФГаЫШЄаЁзщгУ 0.50molЁЄL-1KIЁЂ0.2ЃЅЕэЗлШмвКЁЂ0.20molЁЄL-1K2S2O8ЁЂ0.10molЁЄL-1Na2S2O3 ЕШЪд МСЃЌЬНОПЗДгІЬѕМўЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЁЃ
вбжЊЃКЂёЁЂS2O82-ЃЋ2I-ЃН2SO42-ЃЋI2(Т§) ЂђЁЂI2ЃЋ2S2O32-ЃН2I- ЃЋS4O62-(Пь)
ЂйЯђ KIЁЂNa2S2O3 гыЕэЗлЕФЛьКЯШмвКжаМгШывЛЖЈСПЕФ K2S2O8 ШмвКЃЌЕБШмвКжаЕФ_____КФ ОЁКѓЃЌШмвКбеЩЋНЋгЩЮоЩЋБфГЩЮЊРЖЩЋЁЃ ЧыДгХізВРэТлЕФНЧЖШНтЪЭЩЯЪіВњЮяЮДКФОЁЧАШмвКжаПДВЛЕНРЖЩЋЕФдвђЃК_____
ЂкЮЊЬНЬжЗДгІЮяХЈЖШЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЃЌЩшМЦЕФЪЕбщЗНАИШчЯТБэЃК
ЪЕбщ ађКХ | ЬхЛ§ V/mL | ||||
K2S2O8 ШмвК | ЫЎ | KI ШмвК | Na2S2O3 ШмвК | ЕэЗлШмвК | |
ЂЁ | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
ЂЂ | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
ЂЃ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
Бэжа Vx=_____mLЃЌРэгЩЪЧ_____ЁЃ
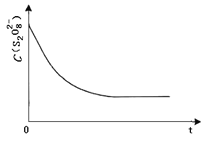
ЂлвбжЊФГЬѕМўЯТЃЌХЈЖШ c (S2O82-)ЁЋЗДгІЪБМф t ЕФБфЛЏЧњЯпШчЭМЃЌШєБЃГжЦфЫћЬѕМўВЛБфЃЌЧыдкД№ЬтПЈзјБъЭМжаЃЌЗжБ№ЛГіНЕЕЭЗДгІЮТЖШКЭМгШыДпЛЏМСЪБ c (S2O82-)ЁЋt ЕФБфЛЏЧњЯпЪОвтЭМ _____(НјааЯргІЕФБъзЂ)
ЁОД№АИЁП5CO (g)+I2O5 (s)ЃН5CO2 (g)+I2 (s) ЁїH=Љ1377.22kJ/mol ЃО Na2S2O3 ЗДгІЂђ ЕФЛюЛЏФмНЯЕЭЃЌЛюЛЏЗжзгАйЗжЪ§КЌСПИпЃЌжЛвЊЩњГЩ I2 ЃЌI2ФмКмПьгы S2O2 -ЗДгІБЛЯћКФЃЌвђДЫжЛгаЕБ S2O32 -КФОЁЪБВХФмПДЕНРЖЩЋ 2.0 БЃжЄЗДгІЮя K2S2O8 ХЈЖШИФБфЃЌЖјЦфЫћЕФВЛБфЃЌВХФмДяЕНЪЕбщФПЕФ 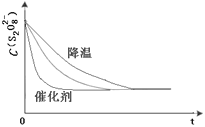
ЁОНтЮіЁП
(1)ИљОнвбжЊШШЛЏбЇЗНГЬЪНЃЌРћгУИЧЫЙЖЈТЩМЦЫуКЭЪщаДШШЛЏбЇЗНГЬЪНЃЛ
(2)ЂйИљОнKIЁЂNa2S2O3гыЕэЗлЕФЗДгІдРэНтД№ЃЌзЂвтЗДгІЙ§ГЬЕФПьТ§ЮЪЬтЃЛЂкИљОнЪЕбщФПЕФМАБэИёЪ§ОнЗжЮіЃЌДгЖјШЗЖЈVxЕФДѓаЁМАРэгЩЃЌзЂвтЬНОПЮяжЪЕФСПХЈЖШЖдЗДгІЫйТЪгАЯьЪБЃЌЦфЫќЬѕМўгІЯрЭЌЃЛЂлНЕЕЭЮТЖШЃЌЛЏбЇЗДгІЫйТЪМѕаЁЃЌдђЕНДяЦНКтЪБМфбгГЄЃЛМгШыДпЛЏМСЃЌдіДѓЗДгІЫйТЪЃЌдђЫѕЖЬЗДгІЕНДяЦНКтЪБМфЃЌОнДЫзїЭМЁЃ
(1)гЩвбжЊШШЛЏбЇЗНГЬЪНЃКЂй2 I2(s)+5O2(g)=2 I2O5(s)ЃЛЁїH=-75.56kJmol-1ЃЌЂк2CO(g)+O2(g)=2 CO2(g)ЃЛЁїH=-566.0kJmol-1ЃЌИљОнИЧЫЙЖЈТЩНЋЗНГЬЪНЂкЁС![]() -ЂйЁС
-ЂйЁС![]() ЕУ5CO(g)+I2O5(s)=5CO2(g)+I2(s) ЁїH=(-566.0kJmol-1)ЁС
ЕУ5CO(g)+I2O5(s)=5CO2(g)+I2(s) ЁїH=(-566.0kJmol-1)ЁС![]() -(-75.56kJmol-1)ЁС
-(-75.56kJmol-1)ЁС![]() =-1377.22kJ/molЃЌЫљвдЦфШШЛЏбЇЗДгІЗНГЬЪНЮЊЃК5CO(g)+I2O5(s)=5 CO2(g)+I2(s) ЁїH=-1377.22kJ/molЃЛИљОнЁїG=ЁїH-TЁїSЃЌШєетИіЗДгІвЛЖЈФмздЗЂНјааЃЌвђЮЊЁїHЃМ0ЃЌдђЗДгІЕФЁїSЃО0ЃЌЙЪД№АИЮЊЃК5CO(g)+I2O5(s)=5 CO2(g)+I2(s) ЁїH=-1377.22kJ/molЃЛЃОЃЛ
=-1377.22kJ/molЃЌЫљвдЦфШШЛЏбЇЗДгІЗНГЬЪНЮЊЃК5CO(g)+I2O5(s)=5 CO2(g)+I2(s) ЁїH=-1377.22kJ/molЃЛИљОнЁїG=ЁїH-TЁїSЃЌШєетИіЗДгІвЛЖЈФмздЗЂНјааЃЌвђЮЊЁїHЃМ0ЃЌдђЗДгІЕФЁїSЃО0ЃЌЙЪД№АИЮЊЃК5CO(g)+I2O5(s)=5 CO2(g)+I2(s) ЁїH=-1377.22kJ/molЃЛЃОЃЛ
(2)ЂйЯђKIЁЂNa2S2O3гыЕэЗлЕФЛьКЯШмвКжаМгШывЛЖЈСПЕФK2S2O8ШмвКЃЌЯШЗЂЩњS2O82-+2I-ЈT2SO42-+I2(Т§)ЃЌКѓЗЂЩњI2+2S2O32-ЈTS4O62-+2I-(Пь)ЃЌЗДгІЂђ ЕФЛюЛЏФмНЯЕЭЃЌЛюЛЏЗжзгАйЗжЪ§КЌСПИпЃЌжЛвЊЩњГЩ I2 ФмКмПьгы S2O2 -ЗДгІБЛЯћКФЃЌвђДЫжЛгаЕБ S2O32 -КФОЁЪБВХФмПДЕНРЖЩЋЃЌЙЪД№АИЮЊЃКNa2S2O3ЃЛЗДгІЂђ ЕФЛюЛЏФмНЯЕЭЃЌЛюЛЏЗжзгАйЗжЪ§КЌСПИпЃЌжЛвЊЩњГЩ I2 ФмКмПьгы S2O2 -ЗДгІБЛЯћКФЃЌвђДЫжЛгаЕБ S2O32 -КФОЁЪБВХФмПДЕНРЖЩЋЃЛ
(2)ЖдееЪЕбщ1КЭ2ЗЂЯжЃЌЪЕбщ2ШЁЕФ0.20molL-1K2S2O8ШмвКЕФЬхЛ§9mLЃЌБШЪЕбщ1ЩйСЫ1mLЃЌЫЕУїШЁЕФK2S2O8ЮяжЪЕФСПЩйЃЌМгЫЎ1mLЃЌБЃжЄСЫШмвКЕФЬхЛ§ВЛБфЃЌЫљвддкЦфЫќЬѕМўВЛБфЕФЧщПіЯТЃЌЬНОПЕФЪЧИУЗДгІЫйТЪгыK2S2O8ХЈЖШЕФЙиЯЕЃЌЭЌбљдРэЖдееЪЕбщ1КЭ3ЃЌЮЊБЃжЄШмвКЕФЬхЛ§ЯрЭЌЃЌаыМг2.0mLЫЎЃЌРэгЩЪЧБЃжЄЦфЫћЬѕМўВЛБфЃЌжЛИФБфЗДгІЮяK2S2O8ХЈЖШЃЌДгЖјДяЕНЖдееЪЕбщЕФФПЕФЃЌЙЪД№АИЮЊЃК2.0ЃЛБЃжЄЗДгІЮя K2S2O8 ХЈЖШИФБфЃЌЖјЦфЫћЕФВЛБфЃЌВХФмДяЕНЪЕбщФПЕФЃЛ
ЂлБЃГжЦфЫќЬѕМўВЛБфЃЌНЕЕЭЮТЖШЃЌЗДгІЫйТЪНЕЕЭЃЌЕНДяШмвКбеЩЋгЩЮоЩЋБфГЩЮЊРЖЩЋЕФЪБМфБфГЄЃЛЖјЪЙгУДпЛЏМСЃЌФмМгПьЛЏбЇЗДгІЫйТЪЃЌЫљвдЕНДяШмвКбеЩЋгЩЮоЩЋБфГЩЮЊРЖЩЋЕФЪБМфБфЖЬЃЌЕЋзюжезДЬЌЯрЭЌЃЌвђДЫc (S2O82-)ЁЋt ЕФБфЛЏЧњЯпЪОвтЭМЮЊ ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК ЁЃ
ЁЃ