题目内容
【题目】高铁酸钾 (K2FeO4)是一种优良的水处理剂,将其溶于水中缓慢发生发应 4FeO42-+10H2O![]() 4Fe (OH)3+8OH -+3O2↑。在 pH=4.7 的溶液中,配成 c (K2FeO4)=1.0×10-3mol·L-1 试样,分别置于 20-60℃的恒 温水浴中,测定 K2FeO4 总量的变化如图,纵坐标为试样的浓度, 则下列说法不正确的是
4Fe (OH)3+8OH -+3O2↑。在 pH=4.7 的溶液中,配成 c (K2FeO4)=1.0×10-3mol·L-1 试样,分别置于 20-60℃的恒 温水浴中,测定 K2FeO4 总量的变化如图,纵坐标为试样的浓度, 则下列说法不正确的是
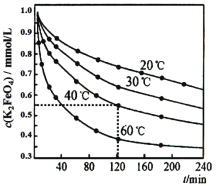
A.试样溶液的酸性越强,K2FeO4 越不稳定
B.40℃时,在 0~120 min 内,K2FeO4 的分解速率为3.75×10-3 mol·Lˉ1·minˉ1
C.由图可知,反应体系温度越高,分解速率越快
D.当分解足够长时间后,四份试样的分解率相等
【答案】D
【解析】
A.根据反应4FeO42-+10H2O4Fe(OH)3+8OH-+3O2↑,溶液的酸性越强,反应进行的程度越大,K2FeO4越不稳定,故A正确;
B.40℃时,在0~120min内,K2FeO4的分解速率为![]() molL-1min-1 = 3.75×10-3molL-1min-1,故B正确;
molL-1min-1 = 3.75×10-3molL-1min-1,故B正确;
C.由图中数据可知,温度越高,相同时间内FeO42-浓度变化越快,分解速率越快,故C正确;
D.当分解足够长时间后,开始浓度相等,但是最后浓度不等,所以四份试样的分解率不会相等,故D错误;
故选D。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】碱式氧化(NiOOH)可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如下:
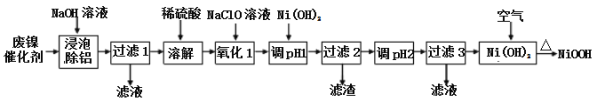
回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_____________________。
(2)“过滤1”用到的玻璃仪器________________________________________。
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为_______________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式________________。
(5)在酸性溶液中CrO![]() 可以转化成Cr2O
可以转化成Cr2O![]() ,用离子方程式表示该转化反应__________,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO
,用离子方程式表示该转化反应__________,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO![]() 沉淀完全(c(CrO
沉淀完全(c(CrO![]() )≦1×10-5mol·L1),溶液中钡离子浓度至少为________mol·L1。
)≦1×10-5mol·L1),溶液中钡离子浓度至少为________mol·L1。
【题目】碘在科研与生活中有重要应用。
(1)I2O5 是白色粉末状固体,在合成氨工业中常用 I2O5 来定量测量 CO 的含量。
已知:2I2 (s)+5O2 (g)=2I2O5 (s) △H=﹣75.56kJ·mol-1
2CO (g)+O2 (g)=2CO2 (g) △H=﹣566.0kJ·mol-1
写出 CO (g)与 I2O5 (s)反应析出固态 I2 的热化学方程式:_____,若这个反应一定能自发进行,则反应的△S_____0(填“>”,“<”或 “=”);
(2)某兴趣小组用 0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3 等试 剂,探究反应条件对化学反应速率的影响。
已知:Ⅰ、S2O82-+2I-=2SO42-+I2(慢) Ⅱ、I2+2S2O32-=2I- +S4O62-(快)
①向 KI、Na2S2O3 与淀粉的混合溶液中加入一定量的 K2S2O8 溶液,当溶液中的_____耗 尽后,溶液颜色将由无色变成为蓝色。 请从碰撞理论的角度解释上述产物未耗尽前溶液中看不到蓝色的原因:_____
②为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验 序号 | 体积 V/mL | ||||
K2S2O8 溶液 | 水 | KI 溶液 | Na2S2O3 溶液 | 淀粉溶液 | |
ⅰ | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
ⅱ | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
ⅲ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中 Vx=_____mL,理由是_____。
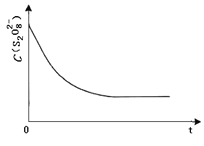
③已知某条件下,浓度 c (S2O82-)~反应时间 t 的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时 c (S2O82-)~t 的变化曲线示意图 _____(进行相应的标注)