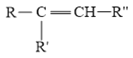题目内容
【题目】CO2和CH4是两种主要的温室气体。以CH4和CO2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。
已知:①CH3OH(g) + 3/2 O2(g) = CO2(g) + 2H2O(l) H1= a kJ/mol②H2(g) + 1/2 O2(g) = H2O(l) H2= b kJ/mol ③H2O(g) = H2O(l) H3= c kJ/mol,则CO2和H2反应生成CH3OH和水蒸气的热化学方程式为_____。
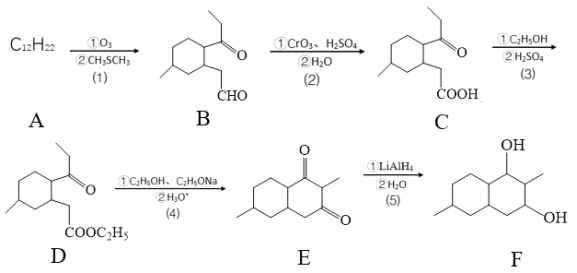
(2)用Cu2Al2O4作催化剂制备乙酸。已知:CO2(g)+CH4(g)![]() CH3COOH(g) H2=akJ/mol。
CH3COOH(g) H2=akJ/mol。
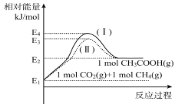
①各物质相对能量大小如图所示,则a=___。
②该反应的速率方程可表示为:v(正)=k正c(CO2)c(CH4)和v(逆)=k逆c(CH3COOH),k正和k逆在一定温度时为常数,分别称作正,逆反应速率常数,请写出用k正,k逆表示的平衡常数的表达式K=___。
(3)将CO2和CH4在一定条件下反应可制得工业合成气,在1 L 密闭容器中通入CH4与CO2,使其物质的量浓度为1.0 mol/L,在一定条件下发生反应:CH4(g) + CO2(g) 2CO(g) + 2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图所示:
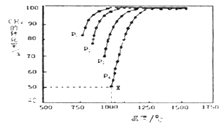
则:
①压强P1,P2,P3,P4由大到小的关系为___。
②对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),如果P4=2 MPa,求x点的平衡常数Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③下列措施中能使平衡体系中c(CO)/c(CO2)减小的是__。
A.升高温度 B.增大压强
C.保持温度、压强不变,充入He D.恒温、恒容,再充入1 mol CO2和1 mol CH4
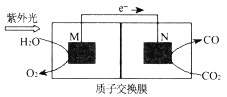
(4)科学家还研究了其他转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,N___极的电极反应式为______,若导线中通过电子为a mol,则M极电解质溶液中H+改变量为___mol,N极电解质溶液m=__g。
【答案】CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) H=(3b-a-c)kJ/mol E2-E1
CH3OH(g) +H2O(g) H=(3b-a-c)kJ/mol E2-E1 ![]() P4>P3>P2>P1
P4>P3>P2>P1 ![]() (MPa)2 BD 正 CO2+2H++2e-=CO+H2O 0 9a
(MPa)2 BD 正 CO2+2H++2e-=CO+H2O 0 9a
【解析】
(1)根据盖斯定律进行分析;
(2)①根据图示可知,该反应为吸热反应,H2=生成物总能量-反应物总能量;
②CO2(g)+CH4(g)![]() CH3COOH(g),平衡常数的表达式K=c(CH3COOH)/c(CH4)c(CO2);反应达到平衡后,v(正)= v(逆),据此可以求出K。
CH3COOH(g),平衡常数的表达式K=c(CH3COOH)/c(CH4)c(CO2);反应达到平衡后,v(正)= v(逆),据此可以求出K。
(3) ①该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,据此分析压强的大小;
②对于气相反应,用某组分(B)的平衡压强P(B)代替物质的量浓度c(B)也可表示平衡常数(记作KP),则该反应的平衡常数的表达式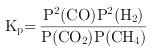 ;结合化学平衡三段式列式计算;
;结合化学平衡三段式列式计算;
③从图示可知,温度升高,甲烷的转化率增大,所以CH4(g) + CO2(g) 2CO(g) + 2H2(g),反应为吸热反应;根据平衡移动规律进行分析;
(4)根据装置中电子流向知,M是负极,N是正极;正极反应式为:CO2+2H++2e-=CO+H2O;M电极反应为:2H2O-4e-=O2+4H+,总反应式为:2CO2= 2CO+ O2;根据导线中通过电子为a mol,分析M极电解质溶液中H+改变量、N极电解质溶液m。
(1)已知①CH3OH(g) + 3/2 O2(g) = CO2(g) + 2H2O(l) H1= a kJ/mol;②H2(g) + 1/2 O2(g) = H2O(l) H2= b kJ/mol ;③H2O(g) = H2O(l) H3= c kJ/mol,根据盖斯定律知, ②×3-①-③得:CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) H=(3b-a-c)kJ/mol;
CH3OH(g) +H2O(g) H=(3b-a-c)kJ/mol;
故答案是: CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) H=(3b-a-c)kJ/mol;
CH3OH(g) +H2O(g) H=(3b-a-c)kJ/mol;
(2)①根据图示可知,该反应为吸热反应,H2=生成物总能量-反应物总能量 = E2-E1=a kJ/mol;
故答案是:E2-E1;
②CO2(g)+CH4(g)![]() CH3COOH(g),平衡常数的表达式K=c(CH3COOH)/c(CH4)c(CO2);反应达到平衡后,v(正)= v(逆),所以k正c(CO2)c(CH4)= k逆c(CH3COOH),因此
CH3COOH(g),平衡常数的表达式K=c(CH3COOH)/c(CH4)c(CO2);反应达到平衡后,v(正)= v(逆),所以k正c(CO2)c(CH4)= k逆c(CH3COOH),因此![]() = c(CH3COOH)/c(CH4)c(CO2)= K;
= c(CH3COOH)/c(CH4)c(CO2)= K;
故答案是: (3) ①由图可以知道,温度一定时,甲烷的转化率α(P1)> α(P2)> α(P3) >α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1; 故答案是: P4>P3>P2>P1; ②对于气相反应,用某组分(B)的平衡压强P(B)代替物质的量浓度c(B)也可表示平衡常数(记作KP),则该反应的平衡常数的表达式 CH4(g) + CO2(g) 2CO(g) + 2H2(g) 起始量(mol) 1 1 0 0 变化量(mol) 0.5 0.5 1 1 平衡量(mol) 0.5 0.5 1 1 平衡气体总物质的量=3mol,如果P4=2 MPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,则a点的平衡常数KP=[(2×1/3)2×(2×1/3)2]÷(2×0.5/3)2= 故答案是: ③从图示可知,温度升高,甲烷的转化率增大,所以CH4(g) + CO2(g) 2CO(g) + 2H2(g),反应为吸热反应; A.升高温度,平衡右移,c(CO2)减小,c(CO)增大,所以c(CO)/c(CO2)增大,故A错误; B.该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,c(CO2)增大,c(CO)减小,所以c(CO)/c(CO2)减小,故B正确; C.保持温度、压强不变,充入He,气体体积增大,平衡向右移动,c(CO2)减小,c(CO)增大,所以c(CO)/c(CO2)增大,故C错误; D.恒温、恒容,再充入1 mol CO2和1 mol CH4,与原平衡相比等效于加压过程,平衡左移,c(CO2)增大,c(CO)减小,所以c(CO)/c(CO2)减小,故D正确; 故答案是:BD。 (4)该装置中,根据电子流向知,M是负极,N是正极;正极发生还原反应,反应式为:CO2+2H++2e-=CO+H2O;M电极反应为:2H2O-4e-=O2+4H+,总反应式为:2CO2= 2CO+ O2;故导线中通过电子为a mol,则M极电解质溶液中H+改变量为amol;根据CO2+2H++2e-=CO+H2O反应可知,导线中通过电子为a mol时, N极电解质溶液增加量为m=(22a+a)-14a=9ag; 故答案是:正;CO2+2H++2e-=CO+H2O;0;9a。![]() ;
;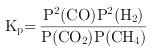 ;结合化学平衡三段式列式计算,设体积为1L,a点甲烷转化率为50%;
;结合化学平衡三段式列式计算,设体积为1L,a点甲烷转化率为50%;![]() (MPa)2 ;
(MPa)2 ;![]() (MPa)2 ;
(MPa)2 ;