题目内容
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)= mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)= mol。
(3)温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热”)。
(4)700℃时,向容积2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
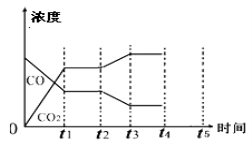
(5)该反应在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是 、 (写出两种)。
(6)若该容器体积不变,能判断反应达到平衡的是 。
①c(CO)与c(H2)的比值保持不变
②v(CO2)正=v(H2O)逆
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥气体的平均相对分子质量不变
【答案】(1)0.2/t1 (2)0.40 (3)放热
(4)> (5)降温;提高c(H2O);减小c(H2)
(6)①②⑤
【解析】
试题分析:(1)t1min内消耗水0.4mol,生成氢气0.4mol,反应在t1min内的平均速率为v(H2)=![]() 0.2/t1mol·L-1·min-1; t1min时n(CO)= 0.80,t2min时n(CO)= 0.80,说明t1min时达到平衡状态,则
0.2/t1mol·L-1·min-1; t1min时n(CO)= 0.80,t2min时n(CO)= 0.80,说明t1min时达到平衡状态,则![]() 1,保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=xmol,则
1,保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=xmol,则![]() ,x=0.4mol;(3)温度升至800℃,上述反应平衡常数为0.64,,平衡常数减小,则正反应为放热反应;(4)
,x=0.4mol;(3)温度升至800℃,上述反应平衡常数为0.64,,平衡常数减小,则正反应为放热反应;(4)![]() ,则此时该反应v(正)>v(逆);(5)该反应在t1时刻达到平衡、在t2时刻c(CO2)逐渐增大,c(CO)逐渐减小,说明平衡正向移动,改变条件可能是降温;提高c(H2O);(6)若该容器体积不变,能判断反应达到平衡的是①CO是反应物、H2是生成物c(CO)与c(H2)的比值保持不变,一定平衡; ②正逆反应速率相同,v(CO2)正=v(H2O)逆,一定平衡;
,则此时该反应v(正)>v(逆);(5)该反应在t1时刻达到平衡、在t2时刻c(CO2)逐渐增大,c(CO)逐渐减小,说明平衡正向移动,改变条件可能是降温;提高c(H2O);(6)若该容器体积不变,能判断反应达到平衡的是①CO是反应物、H2是生成物c(CO)与c(H2)的比值保持不变,一定平衡; ②正逆反应速率相同,v(CO2)正=v(H2O)逆,一定平衡;
③![]() ,体系的压强不再发生变化,不一定平衡 ; ④根据
,体系的压强不再发生变化,不一定平衡 ; ④根据![]() ,密度为恒量,混合气体的密度不变 ,不一定平衡; ⑤该反应放热,体系的温度不再发生变化,一定平衡,⑥根据
,密度为恒量,混合气体的密度不变 ,不一定平衡; ⑤该反应放热,体系的温度不再发生变化,一定平衡,⑥根据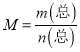 ,平均相对分子质量为恒量,气体的平均相对分子质量不变,不一定平衡。
,平均相对分子质量为恒量,气体的平均相对分子质量不变,不一定平衡。

【题目】已知H2(g)+Br2(l)=2HBr(g);△H=-72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
化学物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量/KJ | 436 | a | 369 |
则表中a为( )
A.404 B.260 C.230 D.200