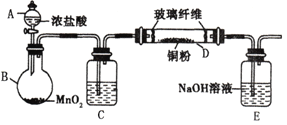
题目内容
【题目】纳米材料镍粉(Ni)是一种高性能电极材料。其制备过程如下:
步骤I:取0.2 mol·L-1的硝酸镍溶液,调节pH除铁后,加入活性炭过滤。
步骤Ⅱ:向所得滤液中滴加1.5mol·L-1的NaHCO3溶液使Ni2+完全沉淀,生成xNiCO3·yNi(OH)2·zH2O。
步骤Ⅲ:将产生的沉淀用大量高纯水清洗并用离心机甩干。
步骤Ⅳ:加入稍过量的肼溶液(N2H4·H2O),使上述沉淀还原完全,将生成的Ni水洗后,再用95%的乙醇浸泡后晾干。
⑴步骤I中去除杂质Fe3+(使其浓度<10-6 mol·L-1),需调节溶液pH的范围为___________。(Ksp[Ni(OH)2]=2×10-15,Ksp[Fe(OH)3]=1×10-39)
⑵当x:y:z=1:1:1时,写出步骤Ⅱ中产生沉淀的离子方程式:___________。
⑶步骤Ⅳ中采用95%的乙醇浸泡的目的是___________。
⑷为测定xNiCO3·yNi(OH)2·zH2O的组成,进行如下实验:
①准确称取7.54 g样品与过量的肼溶液(N2H4·H2O)充分反应,共收集到1.12 LN2和CO2混合气体(已换算成标准状况)。
②另取等质量的样品充分灼烧,冷却后称得残留固体NiO的质量为4.5g。
通过计算确定xNiCO3·yNi(OH)2·zH2O的化学式__________(写出计算过程)。
【答案】 3~7 2Ni2++4HCO3-=NiCO3·Ni(OH)2·H2O↓+3CO2↑ 除去水,便于快速晾干 n(CO2) + n(N2)=![]() =0.05mol;n(NiO)=
=0.05mol;n(NiO)=![]() =0.06mol。
=0.06mol。
设7.54g样品中含有NiCO3、Ni(OH)2的物质的量分别为a、b,则有:a + ![]() =0.05mol,a+b=0.06mol ;解得:a=0.02 mol、b=0.04 mol。7.54g样品中含有结晶水的物质的量:n(H2O)=(7.54g-0.02mol×119 g·mol—1-0.04mol×93 g·mol—1)÷18 g·mol—1=0.08 mol,n(NiCO3):n[Ni(OH)2]:n (H2O)=0.02 mol:0.04 mol:0.08 mol =1:2:4 ,故该样品的化学式为NiCO3·2Ni(OH)2·4H2O
=0.05mol,a+b=0.06mol ;解得:a=0.02 mol、b=0.04 mol。7.54g样品中含有结晶水的物质的量:n(H2O)=(7.54g-0.02mol×119 g·mol—1-0.04mol×93 g·mol—1)÷18 g·mol—1=0.08 mol,n(NiCO3):n[Ni(OH)2]:n (H2O)=0.02 mol:0.04 mol:0.08 mol =1:2:4 ,故该样品的化学式为NiCO3·2Ni(OH)2·4H2O
【解析】 ⑴根据Ksp[Ni(OH)2]=2×10-15,Ksp[Fe(OH)3]=1×10-39,Ni2+开始沉淀的pH=14-(-lg ) =14-(-lg
) =14-(-lg![]() )=14-(-lg1×10-7)=7,Fe3+沉淀完全时的pH=14-(-lg
)=14-(-lg1×10-7)=7,Fe3+沉淀完全时的pH=14-(-lg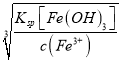 ) =14-(-lg
) =14-(-lg![]() )=14-(-lg1×10-11)=3,步骤I中去除杂质Fe3+,需调节溶液pH的范围为3~7,故答案为:3~7;
)=14-(-lg1×10-11)=3,步骤I中去除杂质Fe3+,需调节溶液pH的范围为3~7,故答案为:3~7;
⑵当x:y:z=1:1:1时,步骤Ⅱ中产生沉淀的离子方程式为2Ni2++4HCO3-=NiCO3·Ni(OH)2·H2O↓+3CO2↑,故答案为:2Ni2++4HCO3-=NiCO3·Ni(OH)2·H2O↓+3CO2↑;
⑶步骤Ⅳ中采用95%的乙醇浸泡可以除去水,便于快速晾干,故答案为:除去水,便于快速晾干;
(4). n(CO2) + n(N2)=![]() =0.05mol;n(NiO)=
=0.05mol;n(NiO)=![]() =0.06mol。
=0.06mol。
设7.54g样品中含有NiCO3、Ni(OH)2的物质的量分别为a、b,则有:a + ![]() =0.05mol,a+b=0.06mol ;解得:a=0.02 mol、b=0.04 mol。7.54g样品中含有结晶水的物质的量:n(H2O)=(7.54g-0.02mol×119 g·mol—1-0.04mol×93 g·mol—1)÷18 g·mol—1=0.08 mol,n(NiCO3):n[Ni(OH)2]:n (H2O)=0.02 mol:0.04 mol:0.08 mol =1:2:4 ,故该样品的化学式为NiCO3·2Ni(OH)2·4H2O,故答案为:NiCO3·2Ni(OH)2·4H2O。
=0.05mol,a+b=0.06mol ;解得:a=0.02 mol、b=0.04 mol。7.54g样品中含有结晶水的物质的量:n(H2O)=(7.54g-0.02mol×119 g·mol—1-0.04mol×93 g·mol—1)÷18 g·mol—1=0.08 mol,n(NiCO3):n[Ni(OH)2]:n (H2O)=0.02 mol:0.04 mol:0.08 mol =1:2:4 ,故该样品的化学式为NiCO3·2Ni(OH)2·4H2O,故答案为:NiCO3·2Ni(OH)2·4H2O。

【题目】德国化学家哈伯(F. Haber, 1868-1930)发明的合成氨技术使大气中的氮气变成了生产氮肥的永不枯竭的廉价来源,从而使农业生产依赖土壤的程度减弱,解决了地球上因粮食不足导致的饥饿和死亡问题。因此这位解救世界粮食危机的化学天才获得了1918年诺贝尔化学奖。现在我们在实验室模拟工业制氨的过程,以探究外界条件对平衡的影响。
查阅资料,获得以下键能数据:
化学键 | N≡N | H-H | N-H |
键能/(kJ/mol) | 946 | 436 | 391 |
(1)计算工业合成氨反应的反应热:N2(g)+3H2(g) ![]() 2NH3(g) △H=________ kJ/mol
2NH3(g) △H=________ kJ/mol
(2)一定温度下,向一个恒压容器中充入N20.6mol,H2 0 .5mol,在一定温度下进行反应:N2(g)+3H2(g) ![]() 2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
①该温度时容器中平衡体系的平衡常数是______________。
②若保持平衡时的温度和压强不变,继续向平衡体系中通入0.9mol N2,则平衡将_______(填“正向”,“逆向”或“不”)移动。
(3)在两个压强相等,温度分别为T1和T2的容器中充入由1 mol N2和3 molH2组成的混合气体,发生反应N2(g)+3H2(g) ![]() 2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是______________
2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是______________

a.A、 B、 C三点的平衡常数大小关系:KA<KB<KC
b.B点和C点的H2浓度大小关系:B<C
c.A点和B点混合气体的密度大小关系:A<B
d.A点和C点混合气体的平均相对分子质量大小关系:A>C
(4)合成氨工业会产生大量副产物CO2,工业上常用高浓度的K2CO3溶液吸收CO2,,得溶液X,再利用电解法K2CO3溶液再生,其装置如图所示:

①在阳极区发生的反应包括____________________和H++ HCO3-=H2O+CO2↑。
②简述CO32-在阴极区再生的原理________________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
2H2(g)+ O2(g)=2H2O(g) Δ H1=-484kJ/mol
2CH3OH(g)+3 O2(g)=2CO2(g)+4H2O(g) Δ H2=-1352kJ/mol
写出CO2和H2生成1molCH3OH(g)的热化学方程式_______________。