��Ŀ����
����ͭ��һ��Ӧ�ü���㷺�Ļ���ԭ�ϣ�ͭ������ϡ����ֱ�ӷ�Ӧ����ʵ���н�����Ũ����ֶ�μ��뵽ͭ����ϡ����Ļ�����У�����ʹ֮��Ӧ��ȫ��ͨ���������ᾧ�õ�����ͭ����(װ����ͼ1��2��ʾ)��

(1)ͼ1��A����������________����ƿ�з��������ӷ�Ӧ����ʽΪ��________
(2)ͼ2��ͼ1�ĸĽ�װ�ã����ŵ��У�
��________________����________________��
(3)Ϊ������ɫ��ѧ��Ҫ��ij�о���ѧϰС�����������ƣ�
��һ�飺�Կ���Ϊ��������
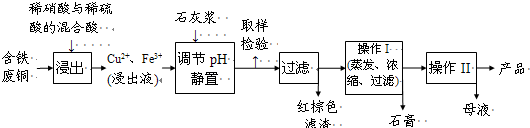
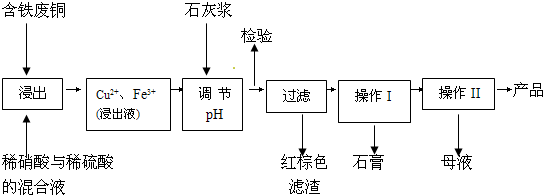
����1���Կ���Ϊ����������ͭ��������B�з������գ�ʹͭ�������ַ�Ӧ��������ͭ���ٽ�����ͭ��ϡ���ᷴӦ��
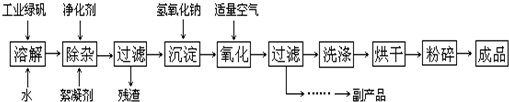
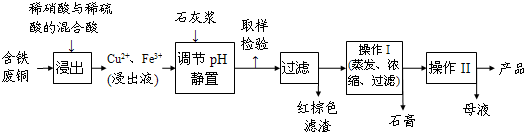
����2��������������ֱ��ͨ�뵽ͭ����ϡ����Ļ�����У������ڳ����¼�������Ӧ����ӦҺ�м�FeSO4��Fe2(SO4)3����������Ӧ����Ӧ��ȫ�������м����ʼ���pH��3��4������Fe(OH)3���������ˡ��������ᾧ������������ѭ��ʹ�ã�(��֪Fe(OH)3��Cu(OH)2��ȫ����ʱ��pH�ֱ�Ϊ3��7��6��4��)
��ش��������⣺
�ٷ���1�е�B����������________��
�ڷ���2�м�������________(����ĸ���)��
a��CaO��b��CuCO3��c��CaCO3��d��NH3��H2O
�ڶ��飺��������Ϊ��������
��3.2 gͭ˿�ŵ�45 mL��1.5 mol/L��ϡ�����У�������50�森����18 mL��10����H2O2����Ӧ0.5Сʱ�����µ�60�棬������Ӧ1Сʱ���ˡ������ᾧ����ѹ���˵ȣ�������95���ľƾ���ϴ�����ɣ���CuSO4��5H2O��10.6 g��
��ش��������⣺
�ۼ���ʱ�¶Ȳ��˹��ߵ�ԭ����________________��������þƾ���ϴ���ŵ���________________��
�����������������У���������ɫ��ѧ�������________(���һ�顱�ڶ��顱)��������_________��_________��_________��
������
|
����(1)��Һ©��(1��)��3Cu��8H+��2NO ����(2)��ֹ����(1��)���к������ܱ���ȫ����(1��) ����(3)������(1��) ������b(1��) �����۷�ֹ˫��ˮ�ֽ�(1��)���ƾ���ˮ�����Ҽ��ӷ������پ����ܽ�(1��) �����ܵڶ���(1��)����һ�鷽��1��Ҫ���գ���������Դ(1��)����һ�鷽��2���ò�Ʒ������Ԫ������(1��)�����ڶ��鷽�������������к����壬�����ò�Ʒ���Ƚϸ�(1��) |

 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д� ����������������ϵ�д�
����������������ϵ�д�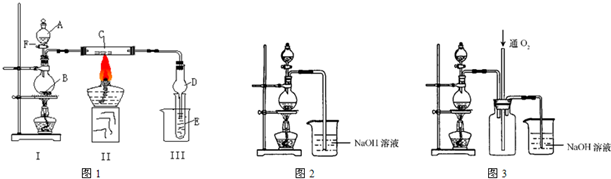
 ����ͭ��һ��Ӧ�ü���㷺�Ļ���ԭ�ϣ�ͭ������ϡ����ֱ�ӷ�Ӧ����ʵ���н�����Ũ����ֶ�μ��뵽ͭ����ϡ����Ļ�����У�����ʹ֮��Ӧ��ȫ��ͨ���������ᾧ�õ�����ͭ���壨װ����ͼ��ʾ����
����ͭ��һ��Ӧ�ü���㷺�Ļ���ԭ�ϣ�ͭ������ϡ����ֱ�ӷ�Ӧ����ʵ���н�����Ũ����ֶ�μ��뵽ͭ����ϡ����Ļ�����У�����ʹ֮��Ӧ��ȫ��ͨ���������ᾧ�õ�����ͭ���壨װ����ͼ��ʾ����