题目内容
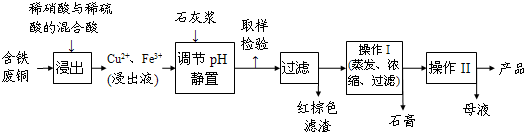
(2009?徐汇区二模)硫酸铜是一种应用极其广泛的化工原料.以下是某工厂用含铁废铜为原料生产胆矾(CuSO4?5H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
请回答下列问题:
(1)红棕色滤渣的主要成分是
(2)写出浸出过程中生成硫酸铜的化学方程式
(3)操作I的操作温度应该控制在
(4)从溶液中分离出硫酸铜晶体的操作II应为
(5)取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;方案二:径向层析→喷KSCN溶液
①你认为上述两种方案设计更合理的是
②指出你认为不合理的方案存在的问题
(6)反应产物中的NO可以循环使用,用化学方程式表示循环使用的方案

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
(1)红棕色滤渣的主要成分是
Fe(OH)3
Fe(OH)3
;(2)写出浸出过程中生成硫酸铜的化学方程式
3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O
3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O
;(3)操作I的操作温度应该控制在
100
100
℃左右;(4)从溶液中分离出硫酸铜晶体的操作II应为
冷却结晶、过滤
冷却结晶、过滤
、洗涤、干燥;(5)取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;方案二:径向层析→喷KSCN溶液
①你认为上述两种方案设计更合理的是
方案二
方案二
;②指出你认为不合理的方案存在的问题
Cu2+的蓝色对检验有干扰
Cu2+的蓝色对检验有干扰
;(6)反应产物中的NO可以循环使用,用化学方程式表示循环使用的方案
4NO+3O2+H2O=4HNO3
4NO+3O2+H2O=4HNO3
.分析:(1)由工艺流程图转化关系可知,红褐色滤渣的主要成分为氢氧化铁.
(2)由工艺流程图转化关系可知,由于硫酸的存在,酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水.
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,物质分离较完全,制备的胆矾较纯.
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥.
(5)确认Fe3+是否除净应注意铜离子的颜色造成的干扰
(6)一氧化氮循环使用可以利用一氧化氮和氧气再水溶液中反应生成硝酸,重新使用.
(2)由工艺流程图转化关系可知,由于硫酸的存在,酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水.
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,物质分离较完全,制备的胆矾较纯.
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥.
(5)确认Fe3+是否除净应注意铜离子的颜色造成的干扰
(6)一氧化氮循环使用可以利用一氧化氮和氧气再水溶液中反应生成硝酸,重新使用.
解答:解:(1)由工艺流程图转化关系可知,浸出液中加入石灰浆调节pH值,铁离子转化为Fe(OH)3沉淀析出,红褐色滤渣的主要成分为Fe(OH)3,故答案为:Fe(OH)3.
(2)由于硫酸的存在,且酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水,反应方程式为3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O,
故答案为:3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,温度应该控制在100℃,制备的胆矾相对较纯,
故答案为:100℃;
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥,故答案为:冷却结晶、过滤;
(5)①方案一:取样于试管→滴加KSCN溶液,由于溶液中含有蓝色的铜离子会对现象干扰,不能检验铁离子的存在;方案二:径向层析→喷KSCN溶液,纸上层析是利用混合物中各组分在固定相和流动相中的溶解度不同而达到分离目的,不但可以分辨出铁离子还能辨别出含有铜离子,故答案为:方案二;
②取样于试管→滴加KSCN溶液,由于溶液中含有蓝色的铜离子会对现象干扰,不能检验铁离子的存在,故答案为:Cu2+的蓝色对检验有干扰;
(6)一氧化氮气体有毒污染空气不能排放到大气中,可以利用一氧化氮和氧气在水溶液中吸收生成硝酸循环使用反应的化学方程式4NO+3O2+H2O=4HNO3,故答案为:4NO+3O2+H2O=4HNO3.
(2)由于硫酸的存在,且酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水,反应方程式为3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O,
故答案为:3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,温度应该控制在100℃,制备的胆矾相对较纯,
故答案为:100℃;
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥,故答案为:冷却结晶、过滤;
(5)①方案一:取样于试管→滴加KSCN溶液,由于溶液中含有蓝色的铜离子会对现象干扰,不能检验铁离子的存在;方案二:径向层析→喷KSCN溶液,纸上层析是利用混合物中各组分在固定相和流动相中的溶解度不同而达到分离目的,不但可以分辨出铁离子还能辨别出含有铜离子,故答案为:方案二;
②取样于试管→滴加KSCN溶液,由于溶液中含有蓝色的铜离子会对现象干扰,不能检验铁离子的存在,故答案为:Cu2+的蓝色对检验有干扰;
(6)一氧化氮气体有毒污染空气不能排放到大气中,可以利用一氧化氮和氧气在水溶液中吸收生成硝酸循环使用反应的化学方程式4NO+3O2+H2O=4HNO3,故答案为:4NO+3O2+H2O=4HNO3.
点评:本题考查学生对工艺流程的理解、阅读题目获取信息能力、物质分离提纯等基本操作、作图能力等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.

练习册系列答案
相关题目
