题目内容
【题目】细菌冶金是近年来新兴的绿色冶金工艺,它主要是应用细菌法溶浸贫矿、废矿、尾矿和炉渣等,以回收某些贵重有色金属和稀有金属,节约矿产资源,最大限度地利用矿藏的一种冶金方法。其中细菌治铜的生产流程为:
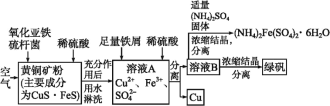
(1)上述生产流程中有三步用到了同一种分离方法,实验室中不能用这种分离方法来分离液态胶体中分散质的原因是___。
(2)绿矾(FeSO4·7H2O)是一种良好的还原剂,也可用来制取治疗缺铁性贫血的药剂和食品调味剂。在保存绿矾时,必须___。在溶液B中加入适量(NH4)2(SO4)2固体,加热浓缩时,可以得到(NH4)2Fe(SO4)4·6H2O的原因是___。
(3)溶液B中一定含有的金属阳离子是___。若在溶液A中加入少量铁屑只发生其中的一个反应,则此反应的平衡常数的表达式为___。
(4)写出黄铜矿中的CuS·FeS在氧化亚铁硫杆菌作用下被空气氧化生成溶液A的离子方程式:___。
(5)氧化亚铜可用作船底防污漆,以杀死低级海生动物而保护船体,也可用作陶瓷和搪瓷的着色剂和红色玻璃的染色剂,氧化亚铜也是一种重要的半导体材料。请用浓的强碱溶液,根据反应2Cu+H2O![]() Cu2O+H2↑,设计出工业生产氧化亚铜的一种方法:___(只要求画实验装置图,其他必要材料任选)。
Cu2O+H2↑,设计出工业生产氧化亚铜的一种方法:___(只要求画实验装置图,其他必要材料任选)。
【答案】胶体的分散质(或胶体粒子)能透过滤纸 密封保存,防止被空气中氧气氧化 相同温度下,硫酸亚铁铵在水中的溶解度比FeSO4和(NH4)2SO4的溶解度小 Fe2+ K=![]() 4CuS·FeS+17O2+4H+
4CuS·FeS+17O2+4H+![]() 4Cu2++4Fe3++8SO42-+2H2O
4Cu2++4Fe3++8SO42-+2H2O 
【解析】
(1)题给生产流程中有三步用到了同一种分离方法是过滤,胶体分散质粒子能通过滤纸,所以不能用过滤法来分离液态胶体中的分散质;
(2)绿矾是一种良好的还原剂,易被氧化,所以保存绿矾时必须密封保存,防止被空气中的氧气氧化;相同温度下,硫酸亚铁铵在水中的溶解度比FeSO4和(NH4)2SO4的溶解度小,所以在溶液B中加入适量(NH4)2SO4固体,加热浓缩时,可以得到(NH4)2Fe(SO4)2·6H2O;
(3)溶液A中的Fe3+、Cu2+都能与铁屑反应生成Fe2+,所以加入足量铁粉后溶液中一定含有的金属阳离子是Fe2+;氧化性Fe3+>Cu2+,加入少量铁屑只发生Fe和Fe3+的反应,可得平衡常数的表达式;
(4)CuSFeS在氧化亚铁硫杆菌作用下被空气中的氧气氧化生成Fe3+、Cu2+和SO42-;
(5)根据反应2Cu+H2O![]() Cu2O+H2↑,铜失电子发生氧化反应,可用电解法制备氧化亚铜,铜作阳极。
Cu2O+H2↑,铜失电子发生氧化反应,可用电解法制备氧化亚铜,铜作阳极。
(1)题给生产流程中有三步用到了同一种分离方法是过滤,胶体分散质粒子能通过滤纸,所以不能用过滤法来分离液态胶体中的分散质;
(2)绿矾是一种良好的还原剂,易被氧化,所以保存绿矾时必须密封保存,防止被空气中的氧气氧化;相同温度下,硫酸亚铁铵在水中的溶解度比FeSO4和(NH4)2SO4的溶解度小,所以在溶液B中加入适量(NH4)2SO4固体,加热浓缩时,可以得到(NH4)2Fe(SO4)2·6H2O;
(3)溶液A中的Fe3+、Cu2+都能与铁屑反应生成Fe2+,所以加入足量铁粉后溶液中一定含有的金属阳离子是Fe2+;氧化性Fe3+>Cu2+,加入少量铁屑只发生Fe和Fe3+的反应,平衡常数的表达式为K=![]() ;
;
(4)CuSFeS在氧化亚铁硫杆菌作用下被空气中的氧气氧化生成Fe3+、Cu2+和SO42-,反应的离子方程式为4CuS·FeS+17O2+4H+![]() 4Cu2++4Fe3++8SO42-+2H2O;
4Cu2++4Fe3++8SO42-+2H2O;
(5)根据反应2Cu+H2O![]() Cu2O+H2↑,铜失电子发生氧化反应,可用电解法制备氧化亚铜,铜作阳极,因此可设计工业生产氧化亚铜的装置图是
Cu2O+H2↑,铜失电子发生氧化反应,可用电解法制备氧化亚铜,铜作阳极,因此可设计工业生产氧化亚铜的装置图是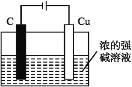 。
。

 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案