题目内容
【题目】按要求回答下列问题:
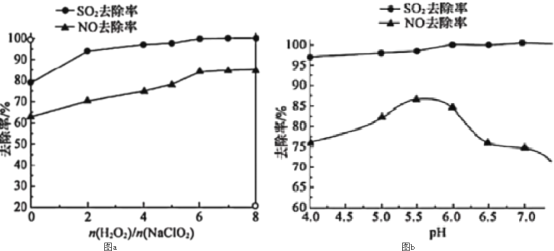
(1)取3.0 g有机物X,完全燃烧后生成3.6 g水和3.36 L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为30,求该有机物的分子式________。X的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是_____(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(2)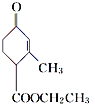 中的含氧官能团名称是________。
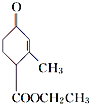
中的含氧官能团名称是________。
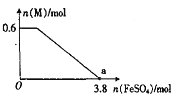
(3)分子式为C6H12 的某烃的所有碳原子都在同一平面上,则该烃的结构简式为________,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为___________。
(4)肉桂酸苯甲酯G是一种香料,主要用于配制人造龙涎香,也可作皂用、化妆用及食用香精的调香原料。如图是用乙烯和甲苯为原料合成肉桂酸苯甲酯的路线图。
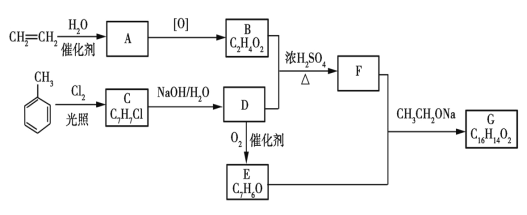
已知:RCHO+CH3COOR'![]() RCH=CHCOOR'。回答下列问题:
RCH=CHCOOR'。回答下列问题:
①A的结构简式是________,F的分子式是___________。
②C生成D的化学方程式是____________。
③D生成E的反应类型是__________。
④含有苯环,与D互为同分异构体的有机物有_____种(不考虑立体异构),其中不能与Na反应的结构简式是___________。
⑤G的结构简式是______________。
【答案】C3H8O c 羰基、酯基 (CH3)2C=C(CH3)2 CH3C≡CCH3 CH3CH2OH或C2H5OH C9H10O2  +NaOH
+NaOH![]()
![]() +NaCl 氧化反应 4
+NaCl 氧化反应 4 ![]()
![]()
【解析】
![]() 根据相对密度可知有机物相对分子质量为60,再计算有机物X、二氧化碳、水的物质的量,根据原子守恒计算X分子中C、H原子数目,结合相对分子质量计算确定O原子数目,进而确定有机物X的分子式。互为同分异构体的物质,含有的元素相同,含有的基团、H原子种类、高能分解碎片不同;
根据相对密度可知有机物相对分子质量为60,再计算有机物X、二氧化碳、水的物质的量,根据原子守恒计算X分子中C、H原子数目,结合相对分子质量计算确定O原子数目,进而确定有机物X的分子式。互为同分异构体的物质,含有的元素相同,含有的基团、H原子种类、高能分解碎片不同;![]() 由结构可知,含有的含氧官能团有:酯基、羰基;
由结构可知,含有的含氧官能团有:酯基、羰基;![]() 分子式为
分子式为![]() 的某烃的所有碳原子都在同一平面上,理解为乙烯中4个H原子被4个甲基替代。若分子式为
的某烃的所有碳原子都在同一平面上,理解为乙烯中4个H原子被4个甲基替代。若分子式为![]() 的某烃中所有的碳原子都在同一条直线上,则理解为乙炔中2个H原子被2个甲基替代;
的某烃中所有的碳原子都在同一条直线上,则理解为乙炔中2个H原子被2个甲基替代;![]() 乙烯与水发生加成反应生成A为
乙烯与水发生加成反应生成A为![]() ,结合B的分子式,可知乙醇氧化生成B为
,结合B的分子式,可知乙醇氧化生成B为![]() ;甲苯与氯气在光照条件下发生甲基上取代,结合C的分子式可知C为
;甲苯与氯气在光照条件下发生甲基上取代,结合C的分子式可知C为![]() ;C发生水解反应生成D为
;C发生水解反应生成D为![]() ;乙酸与苯甲醇发生酯化反应生成F为
;乙酸与苯甲醇发生酯化反应生成F为![]() ;由E的分子式,可知D氧化生成E为
;由E的分子式,可知D氧化生成E为![]() ;由G的分子式、结合给予的反应信息,可知G为
;由G的分子式、结合给予的反应信息,可知G为![]() ,据此解答。
,据此解答。
(1)X蒸汽对氢气的相对密度为30,则![]() ,
,![]() ,
,![]() ,
,![]() ,所以,有机物X分子中:
,所以,有机物X分子中:![]() ,
,![]() ,
,![]() ,故有机物X的分子式为:
,故有机物X的分子式为:![]() 。X的同分异构体在质谱仪中的高能碎片不同,在红外光谱中的基团、化学键不完全相同,在核磁共振仪中峰的组数和面积比不同,而元素种类完全相同,c满足,故答案为:C3H8O;c;
。X的同分异构体在质谱仪中的高能碎片不同,在红外光谱中的基团、化学键不完全相同,在核磁共振仪中峰的组数和面积比不同,而元素种类完全相同,c满足,故答案为:C3H8O;c;
(2) 中的含氧官能团名称是羰基和酯基,故答案为:羰基、酯基;
中的含氧官能团名称是羰基和酯基,故答案为:羰基、酯基;
(3)分子式为![]() 的某烃的所有碳原子都在同一平面上,理解为乙烯中4个H原子被4个甲基替代,该烯烃的结构简式为:
的某烃的所有碳原子都在同一平面上,理解为乙烯中4个H原子被4个甲基替代,该烯烃的结构简式为:![]() ,若分子式为
,若分子式为![]() 的某烃中所有的碳原子都在同一条直线上,则理解为乙炔中2个H原子被2个甲基替代,该烃的结构简式为:
的某烃中所有的碳原子都在同一条直线上,则理解为乙炔中2个H原子被2个甲基替代,该烃的结构简式为:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(4)![]() 由上述分析可知,A是乙醇,其结构简式是:CH3CH2OH或C2H5OH,F的结构简式为
由上述分析可知,A是乙醇,其结构简式是:CH3CH2OH或C2H5OH,F的结构简式为![]() ,F的分子式是:
,F的分子式是:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;![]() 生成D为Cl的水解,化学方程式是:
生成D为Cl的水解,化学方程式是: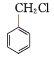 +NaOH
+NaOH![]()
![]() +NaCl,
+NaCl,
故答案为: +NaOH
+NaOH![]()
![]() +NaCl;
+NaCl;
![]() 生成E是苯甲醇发生氧化反应生成苯甲醛,故答案为:氧化反应;
生成E是苯甲醇发生氧化反应生成苯甲醛,故答案为:氧化反应;![]() 含有苯环,与
含有苯环,与![]()
![]()
![]() 互为同分异构体,可以含有一个取代基为
互为同分异构体,可以含有一个取代基为![]() ,可以含有2个取代基为:
,可以含有2个取代基为:![]() 、
、![]() ,有邻、间、对3种,故共有4种,其中不能与Na反应的结构简式是
,有邻、间、对3种,故共有4种,其中不能与Na反应的结构简式是![]() ,故答案为:4;
,故答案为:4;![]() ;
;![]() 由上面的分析可知,G的结构简式是:
由上面的分析可知,G的结构简式是:![]() ,故答案为:
,故答案为:![]() 。
。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案