题目内容
X、Y、Z、T是元索周期表前四周期中的常见元素,其相关信息如下表:
(1) T位于元索周期表第______周期,第______族。
(2) X的电负性比Y______的 (填“大”或“小”);H-X, H-Y两种共价键中,键长较长的是______(用元素符号表示,下同)。
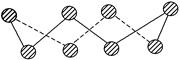
(3) Z的最高价氧化物对应水化物的稀溶液能与单质T反应,写出该反应的化学方程式,并标出电子转移的 方向和数目: __________________。
(4) 在250C、101 kPa时,若适量的Z2和X2完全反应,每生成30 g ZX需要吸收90 kJ热量。则该反应的热化学方程式为____________。
| 元素 | 相关信息 |
| X | X是地壳中含量最多的元素 |
| Y | Y元素原子核外3p能级上有4个电子 |
| Z | 核素Z的质量数为14、中子数为7 |
| T | T的单质是一种常见的金属,其新制的氢氧化物悬浊液可用于检验糖尿病 |
(2) X的电负性比Y______的 (填“大”或“小”);H-X, H-Y两种共价键中,键长较长的是______(用元素符号表示,下同)。
(3) Z的最高价氧化物对应水化物的稀溶液能与单质T反应,写出该反应的化学方程式,并标出电子转移的 方向和数目: __________________。
(4) 在250C、101 kPa时,若适量的Z2和X2完全反应,每生成30 g ZX需要吸收90 kJ热量。则该反应的热化学方程式为____________。
(1)四; ⅠB (各1分)
(2)大;H—S(各2分)
(3)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O (3分)
(4)N2(g)+O2(g)=2NO(g) ΔH=+180KJ/mol (3分)
试题分析:由题意可以推知X、Y、Z、T分别为O、S、N、Cu。
(2)同主族从上到小,非金属减弱,电负性减小,故X>Y;从上到下原子半径逐渐增大,故有H—O<H—S;
(3)铜与稀硝酸反应的产物为NO,电子转移的方向和数目宜用单线桥法(参考答案及2012高考为双线桥)
(4)该反应为N2和O2的反应,生成1molNO放出90KJ的热量,故有热化学方程式为N2(g)+O2(g)=2NO(g) ΔH=+180KJ/mol。

练习册系列答案
相关题目