题目内容
【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(1)Z在元素中期表中的位置是______________________________。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是__________(填离子符号)。
(3)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式______________________________。
(4)Q和R按原子个数比1:1组成的化合物甲是一种“绿色”氧化剂。
①甲中所含共价键类型是____________________。
②空气阴极法电解制备甲的装置如图所示。在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液。图中a是__________极,阴极的电极反应式是____________________。

【答案】 第3周期VIA族 O2- BeO+2OH-=BeO22-+H2O 极性共价键和非极性共价键 正 O2+2e-+2H2O=H2O2+2OH-。
【解析】本题考查元素周期表和元素周期律的应用,根据主族元素最外层电子数等于族序数,因为六种元素为短周期元素, X和M主要化合价为+2价,即位于IIA族,同主族从上到下,原子半径增大,即M为Be,X为Mg,Z和Q的最低价态为-2价,说明这两种元素位于VIA族,同主族从上到下,原子半径增大,即Q为O,Z为S,R为+1价,原子半径最小,因此推出R为H,Y的化合价为+3价,推出Y为IIIA族元素,根据原子半径大小,推出Y为Al,(1)Z为S,位于第三周期VIA族;(2)形成的简单离子分别为Mg2+、Al3+、O2-,核外电子排布相同,半径随着原子序数的递增而减小,即O2->Mg2+>Al3+,因此离子半径最大的是O2-;(3)根据所给信息,Be与Al为对角线,因此BeO具有两性,与强碱反应的离子反应方程式为BeO+2OH-=BeO22-+H2O;(4)①H和O形成1:1的化合物,即为H2O2,其结构式为H-O-O-H,含有共价键类型为极性共价键和非极性共价键;②利用信息,空气中氧气还原得到H2O2,因此氧气得到电子,即通空气一极为阴极,b为负极,a为正极,阴极反应式为O2+2H2O+2e-=H2O2+2OH-。

【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬的铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,为实现铬和铝的再生利用。其工作流程如下:
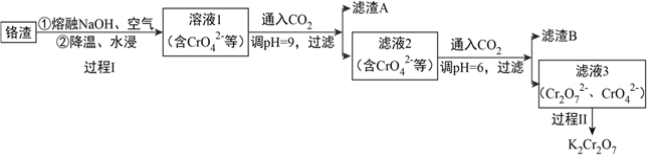
(1)铝热法冶炼金属铬,是利用了金属铝的__________(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、______、_______。
(3)过程I,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是__________。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是____________________。
②滤渣B受热分解所得物质的参与循环利用,B是__________。
③已知:2CrO42-+2H+ ![]() Cr2O72-+H2O K=4.0×1014
Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
(5)过程II的目的是得到K2Cr2O7粗品。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II的操作是:__________________________,过滤,得到K2Cr2O7粗品。