题目内容
9.常温下,下列溶液中微粒浓度关系一定正确的是( )| A. | 氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | 新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
分析 A.常温下,pH=7的溶液中存在c(OH-)=c(H+),根据电荷守恒判断c(Cl-)、c(NH4+)相对大小;
B.新制氯水中含有HCl和HClO,两种酸电离导致溶液呈酸性,但HClO电离程度较小;
C.pH相同的盐酸和醋酸,醋酸浓度大于盐酸;
D.要根据酸的强弱判断混合溶液酸碱性.
解答 解:A.常温下,pH=7的溶液中存在c(OH-)=c(H+),电荷守恒c(Cl-)+c(OH-)=c(H+)+c(NH4+)得c(Cl-)=c(NH4+),故A正确;
B.新制氯水中含有HCl和HClO,两种酸电离导致溶液呈酸性,但HClO电离程度较小,溶液呈酸性,溶液中氢氧根离子浓度很小,所以离子浓度大小顺序是c(H+)>c(Cl-)>>c(ClO-)>c(OH-),故B错误;
C.pH相同的盐酸和醋酸,醋酸浓度大于盐酸,pH、体积相同的盐酸和醋酸,醋酸物质的量大于盐酸,则完全中和酸消耗氢氧化钠物质的量:醋酸>盐酸,故C错误;
D.弱酸酸是弱酸,则酸浓度大于碱,等体积混合时溶液呈酸性;如果酸是强酸,则二者浓度相等,等体积混合时溶液呈中性,故D错误;
故选A.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质成分及其性质是解本题关键,注意守恒思想的灵活运用,易错选项是D.

练习册系列答案
相关题目
19.如图,有机化合物Ⅰ转化为Ⅱ的反应类型是( )


| A. | 氧化反应 | B. | 还原反应 | C. | 取代反应 | D. | 水解反应 |
20.下列说法不正确的是( )
| A. | 为除去FeSO4溶液中的Fe2(SO4)3,可加入铁粉,再过滤 | |
| B. | SO2使溴水褪色,不能说明SO2具有漂白性 | |
| C. | HCl、NO2溶于水都有化学键断裂,但不全属于化学变化 | |
| D. | 为除去CO2中少量的SO2,可使其通过饱和Na2CO3溶液 |
17.下列说法中不正确的是( )
| A. | 反应是放热还是吸热要由反应物和生成物所具有的总能量来决定 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和 50mL 0.50mo1•L-1的硫酸充分反应,两反应测定的中和热是相等的 | |
| D. | 在101KPa时,1mol碳完全燃烧生成二氧化碳气体时放出的热量为碳的燃烧热 |
4.下列行为中符合安全要求的是( )
| A. | 装运乙醇的包装箱上应贴上易燃液体的危险品标志图标 | |
| B. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| C. | 实验时,将水倒入浓硫酸中配制稀硫酸 | |
| D. | 进入煤矿井时,用火把照明 |
14.在一定条件下,向体积为2L的密闭容器中加入2mol N2和10mol H2发生如下反应:N2+3H2?2NH3,2min时测得剩余的N2为1mol,则化学反应速率的表示不正确的是( )
| A. | v(N2)=0.25mol•L-1•min-1 | B. | v(H2)=0.0125 mol•L-1•s-1 | ||
| C. | v(NH3)=1.0 mol•L-1•min-1 | D. | v(H2)=0.75 mol•L-1•min-1 |
1.下列变化过程,属于放热过程的是( )
| A. | 合成氨反应 | B. | 液态水变成水蒸气 | ||
| C. | 弱酸弱碱的电离 | D. | 灼热的炭与CO2的反应 |
18.下列溶液氯离子的物质的量浓度与1mol•L-1AlCl3溶液中氯离子的物质的量浓度相等的是( )
| A. | 3 mol•L-1氯酸钠溶液 | B. | 3 mol•L-1氯化钙溶液 | ||
| C. | 3 mol•L-1氯化钾溶液 | D. | 3 mol•L-1氯化镁溶液 |
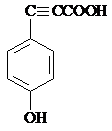 .
.