题目内容
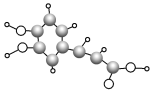
【题目】某有机物M的结构简式为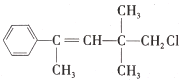 。关于该有机物,下列叙述不正确的是( )
。关于该有机物,下列叙述不正确的是( )
A.M不能与NaOH的醇溶液发生反应
B.1 mol M最多能与4 mol H2发生加成反应
C.M与NaOH溶液共热后,再AgNO3溶液产生白色沉淀
D.M既能使溴水褪色又能使KMnO4酸性溶液褪色
【答案】C
【解析】
A.由于M中与-Cl相连C的邻位C上无H原子,因此不能与NaOH的醇溶液发生消去反应,A正确;
B.苯环、碳碳双键都能与氢气发生加成反应,1 mol M 最多能与4 mol H2发生加成反应,B正确;
C.M与NaOH溶液共热发生水解反应产生NaCl,但溶液中可能含有过量的NaOH会干扰Cl-的检验,应该先加入硝酸酸化,然后再加入AgNO3溶液进行检验,C错误;
D.M含碳碳双键,能与溴水发生加成反应而使溴水褪色,也能被酸性KMnO4溶液氧化而使酸性溶液褪色,D正确;
故合理选项是C。

 天天练口算系列答案
天天练口算系列答案【题目】下列有关实验操作、现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B | NO2球浸泡在冰水中 | 颜色变浅 | 生成N2O4的反应是吸热过程 |
C | Na2S2O3溶液与稀硫酸反应,改变反应的温度 | 只有浑浊产生,温度越高,出现浑浊时间越短 | 温度越高,反应速率越快 |
D | 向重铬酸钾稀溶液中滴加3-10滴浓硫酸 | 溶液橙色加深 | 加酸抑制Cr2O72-向CrO42-的转化 |
A.AB.BC.CD.D
【题目】碳、氮及其化合物在生产、生活中广泛存在。
(1)煤气化的化学方程式为:C(s)+H2O(g)==CO(g)+H2(g) H,该反应在高温下能自发进行,则H_____0(填“>”或“<”)。
(2)煤气化的产物可用于合成甲醇。已知,在刚性容器中,有关反应及其在不同温度下的化学平衡常数如下表所示。
相关化学反应方程式 | 平衡 常数 | 温度(0C) | ||
500 | 700 | 800 | ||
(a)2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
(b)H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
(c)3H2(g)+CO2(g) | K3 | |||
①H1、H2、H3的关系是_____________,H3______0 (填“>”或“<”)
②下列措施能使反应(c)的平衡体系中n(CH3OH):n(CO2)增大的是_______(填字母代号)。
A.将H2O (g)从体系中分离出去 B.充入He (g)
C.升高温度 D.充入1mol H2 (g)
③500℃时,测得反应(c)在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为1.0mol·L-1、0.20mol·L-1、0.50mol·L-1、0.40mol·L-1,则此时反应(c)________。
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断反应状态
(3)CO2

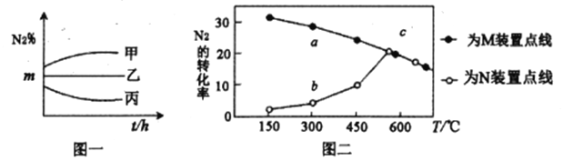
(4)汽车尾气主要有害物质是CO和NO,提高其转化效率是重要的研究课题。在密闭容器中充入5.0 mol CO和4.0 mol NO,发生以下反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。
N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。

①温度:T1_____T2(填“<”或“>”),
② 某温度下,反应达到平衡状态P点时,此时的平衡常数Kp=________________________(只列计算式)。