题目内容
【题目】氨在工农业及国防工业上有广泛的用途。
(1)已知:
①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H=-1266.2k/mol
2N2(g)+6H2O(g) △H=-1266.2k/mol
②2H2(g)+O2(g)![]() 2H2O(g) △H=-483.6kJ/mol
2H2O(g) △H=-483.6kJ/mol
则合成氨反应N2(g)+3H2(g)![]() 2NH3(g) △H=___________kJ/mol,该反应属于___________。
2NH3(g) △H=___________kJ/mol,该反应属于___________。
A.高温自发 B.低温自发 C.恒自发 D.恒不自发
(2)在甲、乙、丙三个容积均为2L的密闭装置中,均充人4mol合成气,但N2、H2的投料比不同,在400℃时反应,测定N2的体积百分含量,得到下图一。
①乙装置中N2、H2的投料比为___________。
②反应达到平衡后,测得乙装置中H2的体积百分含量为25%,则400℃时,合成氨反应的平衡常数为___________(不须注明单位)。
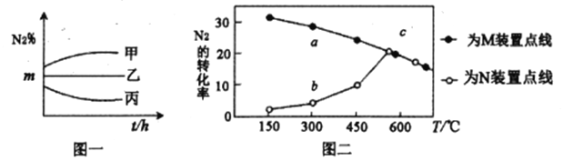
(3)在M、N两个装置中分别充入相同投料比的N2、H2,进行合成氨反应,各反应1小时,测定不同温度下N2的转化率,得到上图二。
①N2、H2在M、N两装置中反应时,不同的条件可能是______________________。
②在300℃时,a、b两点转化率差异的原因是______________________。
(4)氨法烟气脱硫技术渐趋成熟,回收SO2,并产出氮肥,其流程分两步:
①氨水吸收烟气中的SO2:xNH3+SO2(g)+H2O====(NH4)xH2-xSO3
②加入足量的磷酸得到纯净的SO2。写出该反应的化学方程式:______________________。
【答案】-92.3 B 1:1 3.125 M装置中使用了催化剂 M装置中使用了催化剂,a点速率快,达到了平衡,b点速率慢,没达到平衡 (NH4)xH2-xSO3+xH3PO4=xNH4H2PO4+SO2↑+H2O
【解析】
(1)从盖斯定律的计算和反应进行的方向分析;(2)综合考察影响化学平衡移动因素、平衡常数计算、转化率计算等为题。
(1)、已知:①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g),△H=-1266.2k/mol ;②2H2(g)+O2(g)
2N2(g)+6H2O(g),△H=-1266.2k/mol ;②2H2(g)+O2(g)![]() 2H2O(g),△H=-483.6kJ/mol,则合成氨反应N2(g)+3H2(g)
2H2O(g),△H=-483.6kJ/mol,则合成氨反应N2(g)+3H2(g)![]() 2NH3(g),△H=-①/2+3/2②代入得,△H= -92.3 k/mol,反应后气体体积变小,是一个熵减的反应(ΔS<0),由△H-T△S可知ΔH<0,ΔS<0时,在低温下能自发进行。
2NH3(g),△H=-①/2+3/2②代入得,△H= -92.3 k/mol,反应后气体体积变小,是一个熵减的反应(ΔS<0),由△H-T△S可知ΔH<0,ΔS<0时,在低温下能自发进行。
本题答案:△H= -92.3 k/mol;B
(2)、设N2初始投料为a mol,由“三段式”得:
N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g)
起始量(mol): a 4-a 0
变化量(mol): x 3x 2x
平衡量(mol):a-x 4-a-3x 2x
①由题意知N2体积分数为![]() =常数,当a=2时该比值为常数0.5,则N2有2mol,H2有2mol,N2、H2的投料比为1:1。
=常数,当a=2时该比值为常数0.5,则N2有2mol,H2有2mol,N2、H2的投料比为1:1。
②H2的体积百分含量为25%,则![]() ,a=2,则x=0.4,故平衡常数K=
,a=2,则x=0.4,故平衡常数K=![]()
(3)、①相同温度下,相同时间内,M装置中N2转化率比N装置大,则M反应速率也大于N,故M装置中使用了催化剂。
本题答案:M装置中使用了催化剂
②在同温度下,由于M装置中使用了催化剂,其反应速率快得多,在300℃时,a点速率快,先达到了平衡;而b点反应速率慢,还没有达到平衡状态,这是造成a、b两点转化率有差异的原因。
本题答案:M装置中使用了催化剂,a点速率快,达到了平衡,b点速率慢,没达到平衡
(4) 第一步中生成的 (NH4)xH2-xSO3为酸式盐,可与磷酸中H+结合产生SO2和H2O,故第二步加入足量的磷酸反应方程式为 (NH4)xH2-xSO3+xH3PO4=xNH4H2PO4+SO2↑+H2O
本题答案:(NH4)xH2-xSO3+xH3PO4=xNH4H2PO4+SO2↑+H2O