题目内容
【题目】标准状况下,8.8mgCO2通过一定量的Na2O2固体后,最终收集到3.36mL气体,则这3.36mL气体的成分是( )
A.CO2B.CO2和O2C.O2D.无法确定
【答案】B
【解析】
CO2通过一定量的Na2O2固体,发生的反应为2Na2O2+2CO2=Na2CO3+O2,n(CO2)=![]() =2×10-4mol,V(CO2)= 2×10-4mol×22.4L/mol=4.48×10-3L=4.48ml,据此判断。
=2×10-4mol,V(CO2)= 2×10-4mol×22.4L/mol=4.48×10-3L=4.48ml,据此判断。
设参加反应的CO2的体积为xml,生成的氧气的体积为yml,那么
2Na2O2 + 2CO2 = Na2CO3 + O2 ΔV
![]()
![]()
![]()
![]() =
=![]()
![]() =
=![]() 解得x=2.24ml y=1.12ml,可知CO2有剩余,因此3.36ml气体是CO2和O2的混合气体;
解得x=2.24ml y=1.12ml,可知CO2有剩余,因此3.36ml气体是CO2和O2的混合气体;
答案选B。

练习册系列答案
相关题目
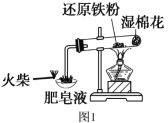
【题目】根据下列实验和现象,所得实验结论正确的是( )
选项 | 实验 | 现象 | 实验结论 |
A | 向某溶液中先滴加适量稀硝酸,再滴加少量BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
B | 将纯碱和硫酸反应生成的气体,通入一定浓度的Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
C |
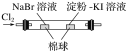
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
D |
| 试管a出现白色沉淀,试管b出现黄色沉淀 | 溶度积:Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D