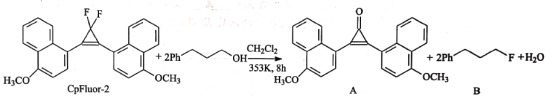
题目内容
【题目】酸在溶剂中的电离是酸中的H+转移给溶剂分子,如:HCl+H2O=H3O++Cl-。已知H2SO4和HNO3在冰醋酸中的电离平衡常数Ka1(H2SO4)=6.3×10-9,Ka(HNO3)=4.2×10-10。下列说法正确的是( )
A.冰醋酸中H2SO4的电离方程式:H2SO4+2CH3COOH=SO42-+2CH3COOH2+
B. H2SO4的冰醋酸溶液中:c(CH3COOH2+)= c(HSO4-)+ 2c(SO42-)+ c(CH3COO-)
C.浓度均为0.1mol/L的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3)
D.向HNO3的冰醋酸溶液中加入冰醋酸,![]() 减小
减小
【答案】B
【解析】
A、H2SO4在冰醋酸中发生部分电离,且以第一步电离为主,则冰醋酸中H2SO4的电离方程式为H2SO4+CH3COOH=HSO4-+CH3COOH2+,故A错误;
B、根据质子守恒,H2SO4的醋酸溶液中存在c(CH3COOH2+)= c(HSO4-)+ 2c(SO42-)+ c(CH3COO-),故B正确;
C、因为Ka1(H2SO4)>Ka(HNO3),故0.1mol/L的两种溶液中硫酸电离的c(CH3COOH2+)大,则其pH小,故C错误;
D、因为![]() =
=![]() =
=![]() ,加入冰醋酸,Ka(HNO3)不变,c(NO3-)减小,比值增大,故D错误;
,加入冰醋酸,Ka(HNO3)不变,c(NO3-)减小,比值增大,故D错误;
答案选B。

练习册系列答案
相关题目