题目内容
【题目】NH3和CO2是两种重要的化工原料。
(1)在一定温度下,在固定体积的密闭容器中发生反应:N2+3H22NH3。该可逆反应达到化学平衡的标志是_________(填字母)。
a.3v(H2)正=2v(NH3)逆
b.单位时间生成m mol N2的同时消耗3m mol H2
c.混合气体的密度不再随时间变化
d.a molN≡N键断裂的同时,有6a mol N-H键断裂
(2)最近科学家们研制成功一种新型催化剂,能将CO2转变为甲烷。在常压、300 ℃,CO2与H2体积比为1∶4时反应,CO2转化率达90%。
①此反应的化学方程式是_________。
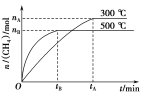
②一定条件下,某兴趣小组,在体积为V L的密闭容器中,模拟此反应达到化学平衡状态。该反应的平衡常数表达式为_________;由上图可知升高温度,K将_________(填“增大”、“减小”或“不变”);300 ℃时,从反应开始,到达到平衡,以H2的浓度变化表示的化学反应速率是_________(用nA、tA、V表示)。
(3)一氧化碳能还原金属氧化物生成金属单质和二氧化碳。下图是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时lgc(CO)/c(CO2)与温度(T)的关系图。
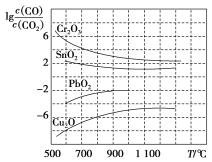
800 ℃时,四种金属氧化物中最易被一氧化碳还原的金属氧化物与CO反应的化学方程式为_________,该反应的平衡常数K=_________。
【答案】bd ![]()
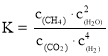 减小
减小 ![]()
![]()
![]()
【解析】
(1)可逆反应达到平衡状态的标志:![]() ,反应混合物中各组分的含量(质量分数、体积分数、物质的量分数)保持不变;
,反应混合物中各组分的含量(质量分数、体积分数、物质的量分数)保持不变;
(2)①在![]() 、新型催化剂的作用下,二氧化碳(
、新型催化剂的作用下,二氧化碳(![]() )与氢气(
)与氢气(![]() )反应生成甲烷(
)反应生成甲烷(![]() )和水(
)和水(![]() );
);
②根据化学平衡常数为生成物的浓度幂之积比反应物的浓度幂之积,列平衡常数的表达式;根据升高温度,平衡的移动,![]() 的变化判断平衡常数的变化,根据化学反应速率是
的变化判断平衡常数的变化,根据化学反应速率是![]() 计算;
计算;
(3)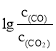 越小,K=
越小,K=![]() 越大,反应程度越大,所以最容易被还原的是
越大,反应程度越大,所以最容易被还原的是![]() 。
。
(1)a.化学反应速率之比等于化学计量数之比,![]() ,
,![]() ,a错误;
,a错误;
b.单位时间生成![]() 是逆反应,同时消耗
是逆反应,同时消耗![]() 是正反应,且,
是正反应,且,![]() ,
,![]() ,b正确;
,b正确;
c.![]() ,
,![]() 不变,
不变,![]() 不,所以
不,所以![]() 不再随时间变化,不能作为判断化学反应达到平衡的标志,c错误;
不再随时间变化,不能作为判断化学反应达到平衡的标志,c错误;
d.![]() 键断裂是正反应,同时
键断裂是正反应,同时![]() 键断裂是逆反应,
键断裂是逆反应,![]() ,
,![]() ,d正确。
,d正确。
(2)①300℃、新型催化剂的作用下,二氧化碳(![]() )与氢气(
)与氢气(![]() )反应生成甲烷(
)反应生成甲烷(![]() )和水(
)和水(![]() ),其化学反应方程式为:
),其化学反应方程式为:![]() ,
,
②化学平衡常数为生成物的浓度幂之积比反应物的浓度幂之积,其平衡常数的表达式为: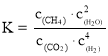 ,根据图可知,升高温度,
,根据图可知,升高温度,![]() 减少,平衡逆向移动,
减少,平衡逆向移动,![]() 减小;在
减小;在![]() 时,
时,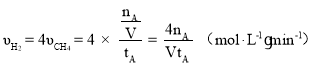 ;
;
(3)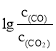 越小,K=
越小,K=![]() 越大,反应程度越大,所以最容易被还原的是
越大,反应程度越大,所以最容易被还原的是![]() ,其化学反应方程式为:
,其化学反应方程式为:![]() ,平衡常数表达式:
,平衡常数表达式:![]() ,
,![]() 时,
时,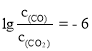 ,
,![]() =106。
=106。