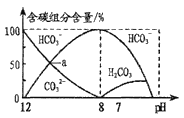
题目内容
【题目】氮化镁(Mg3N2)在工业上具有非常广泛的应用。某化学兴趣小组用镁与氮气反应制备 Mg3N2 并进行有关实验。实验装置如下所示: (部分加热装置已略去)

已知:①氮化镁常温下为浅黄色粉末,极易与水反应。
②亚硝酸钠和氯化铵制取氮气的反应剧烈放热,产生氮气的速度较快。
③温度较高时,亚硝酸钠会分解产生O2等。
回答下列问题:
(1)仪器 b 的名称是__________,写出装置 A 中发生反应的化学方程式___________。
(2)加热至反应开始发生,需移走 A 处酒精灯,原因是__________________。
(3)装置 C 中为饱和硫酸亚铁溶液, 其作用是______________。
(4)定性分析产物
操作步骤 | 实验现象 | 解释原因 |
取少量产品于试管中, 加适量蒸馏水 | 试管底部有固体不溶物,有剌激性气味的气体产生 | 反应的化学方程式为______________________ |
弃去上层淸液, 加入足量稀盐酸 | 观察到固体全部溶解, 且有气泡冒出 | 气泡冒出的原因为________________ |
【答案】蒸馏烧瓶 NH4Cl+NaNO2![]() N2 ↑+NaCl+2H2O 该反应剧烈放热,产生氮气的速度快,移走A处酒精灯能避免反应物冲出,同时避免温度过高,造成NaNO2分解产生O2 除去氧气以免与镁反应 Mg3N2+6H2O=3Mg(OH)2 +2NH3 未反应的镁与盐酸反应产生氢气
N2 ↑+NaCl+2H2O 该反应剧烈放热,产生氮气的速度快,移走A处酒精灯能避免反应物冲出,同时避免温度过高,造成NaNO2分解产生O2 除去氧气以免与镁反应 Mg3N2+6H2O=3Mg(OH)2 +2NH3 未反应的镁与盐酸反应产生氢气
【解析】
先仔细读题上的已知条件及了解实验过程,明确实验目的。该题是用镁与氮气反应制备 Mg3N2 并进行有关实验,首先需要制备氮气,再进行除杂并进行目标反应。
(1)带支管的烧瓶为蒸馏烧瓶;由已知反应物及反应条件推出发生氧化还原反应,生成N2和H2O,则该氧化还原反应式为:NH4Cl+NaNO2![]() N2 ↑+NaCl+2H2O,
N2 ↑+NaCl+2H2O,
故答案为:蒸馏烧瓶;NH4Cl+NaNO2![]() N2 ↑+NaCl+2H2O;
N2 ↑+NaCl+2H2O;
(2)由已知信息知:该反应剧烈放热,产生氮气的速度快,温度过高,会造成NaNO2分解产生O2,生成杂质,
故答案为:该反应剧烈放热,产生氮气的速度快,移走A处酒精灯能避免反应物冲出,同时避免温度过高,造成NaNO2分解产生O2
(3)亚铁离子具有还原性,可以与空气中的氧气或装置A中产生的氧气反应,所以是为了除去氧气,避免产生杂质,
故答案为:除去氧气以免与镁反应;
(4)根据反应物及实验现象可得知,固体不溶物为Mg(OH)2:,有刺激性味气体为NH3:,故反应方程式为:Mg3N2+6H2O=3Mg(OH)2 +2NH3;通过分析现象及产物知,与酸反应有气泡产生,则该处为金属镁,故气泡是未反应的镁与盐酸反应产生氢气;
故答案为:Mg3N2+6H2O=3Mg(OH)2 +2NH3;未反应的镁与盐酸反应产生氢气。

【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000 ℃,可能的原因___________________________________________。
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。

(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565 pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。

【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
① 用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上操作步骤中有一步有错误,请指出编号___,该错误操作会导致测定结果___(填“偏大”、“偏小”或“无影响”)。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入___中,该仪器的名称是___。(从图中选填“甲”或“乙”)
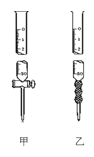
(3)下列操作会引起实验结果偏大的是:___(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断达到滴定终点的现象是:___。
(5)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液的读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.28 |
2 | 20.00 | 0.00 | 18.24 |
通过计算可得,该盐酸浓度为:___mol·L-1(计算结果保留2位小数)。