题目内容
在分别含amol的Na2CO3和NaOH的混合溶液中逐滴滴加稀盐酸,则产生气体与加入盐酸的图像正确的是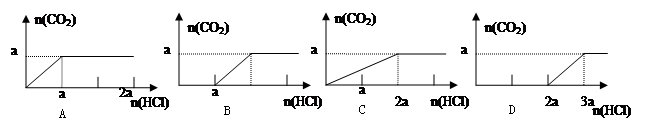
D
解析试题分析:盐酸先与溶液中的NaOH反应,根据方程式H++OH-=H2O,先消耗amol盐酸中和NaOH;再进行反应H++CO32-=HCO3-,又消耗amol盐酸所以D对。
考点:Na2CO3和NaOH与稀盐酸反应的反应顺序,及Na2CO3与盐酸反应的特点。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列反应的离子方程式正确的是
| A.铜片加入三氯化铁溶液中:Cu+2Fe3+= 2Fe2++Cu2+ |
| B.盐酸中加入碳酸钙:CO32-+2H+= H2O+CO2↑ |
| C.AlCl3溶液中加入足量的氨水:Al3++3OH-= Al(OH)3↓ |
| D.NaHCO3溶液中加入盐酸:CO32-+2H+= H2O+CO2↑ |
下列离子方程式的书写与所给条件相符的是
| A.将4 molCl2通入到含有4 mol FeBr2的溶液中:2Cl2+2Fe2++2Br-= 4Cl-+Br2+2Fe3+ |
| B.已知亚硫酸(H2SO3)的第二级电离常数K2比偏铝酸(HAlO2)的电离常数K要大,则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:AlO2-+ SO2+2 H2O =Al(OH)3↓+HSO3- |
| C.稀氨水溶液吸收了少量二氧化碳气体: NH3 ·H2O + CO2 = NH4+ + HCO3- |
| D.在明矾溶液中加入氢氧化钡溶液至沉淀质量达到最大时发生的离子反应是: 2Al3+ +3SO42-+3Ba2++6OH-= 3BaSO4↓+2 Al(OH)3↓ |
下列表示对应化学反应的离子方程式正确的是
| A.用KIO3氧化酸性溶液中的KI: 5I-+IO3-+3H2O =3I2+6OH- |
B.向NH4HCO3溶液中加过量的NaOH溶液并加热: NH4+ +OH- NH3↑+H2O NH3↑+H2O |
| C.将过量SO2通入冷氨水中: SO2+NH3·H2O =HSO3-+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜: Ag+2H++NO3-=Ag++NO↑+H2O |
某溶液可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种①在该溶液中加入足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色的溶液中加入BaC12溶液时无沉淀生成;③向淀粉溶液中滴加该橙黄色溶液未变蓝色,则在该溶液中肯定存在的离子组是
| A.Na+、SO32-、I- | B.Na+、Br-、CO32- |
| C.Fe2+、I-、SO32- | D.Fe2+、CO32-、Br- |
下列指定溶液中,各组离子可能大量共存的是
| A.pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
| B.在强酸溶液中:Na+、ClO-、Cl-、Ba2+ |
| C.在含有大量Fe3+的溶液中:NH4+、Cl-、Na+、SCN- |
| D.由水电离的c(H+)=10-13mol·L-1的溶液中:Mg2+、Cl-、K+、SO42- |
下列物质属于电解质的一组是( )
| A.CO2、NH3、HCl | B.H2SO4、HNO3、BaCl2 |
| C.H3PO4、H2O、Cu | D.液态KNO3、NaOH溶液、C2H5OH |
下列离子方程式中正确的是( )
| A.将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O =SO32-+2HClO |
| B.向FeBr2溶液中通入过量Cl2:2Fe2++4Br-+2Cl2=2Fe3++2Br2+4Cl- |
| C.向硫酸氢钾溶液中加入Ba(OH)2溶液至中性:2H++SO42-+Ba2+ +2OH-= BaSO4↓+2H2O |
| D.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-= NH3↑+H2O |
下列反应的离子方程式书写不正确的是
| A.向漂白液中通入过量CO2:ClO-+H2O+CO2=HClO+HCO3- |
| B.在氯化铝溶液中滴加过量的氨水:Al3++4OH-=AlO2-+ 2H2O |
| C.碳酸氢钠溶液与氢氧化钠反应: OH-+ HCO3-=CO32-+H2O |
| D.碳酸钙粉末与新制的氯水反应:CaCO3+2H+=Ca2++CO2↑+H2O |