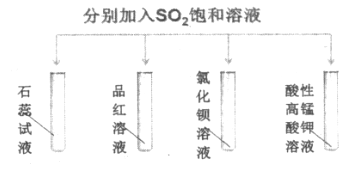
题目内容
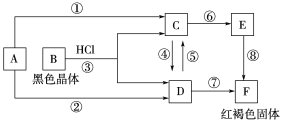
【题目】由C、H、O元素组成的具有果香味的液体A(C4H8O2),可发生下图所示的转化:
(1)写出下列物质的结构简式A_____________,D______________,G_____________。
(2)在C→E的反应中,浓硫酸的作用是_______、_______。
(3)注明C→E反应的类型_________________。
(4)试用实验证明E可以发生加成反应,并写反应的化学方程式_____________。
【答案】CH3COOC2H5 CH3CHO![]() 脱水催化消去把乙烯通入盛有溴水的试管中,溴水的红棕色褪去,说明乙烯与溴发生了加成反应;CH2=CH2+Br2→CH2BrCH2Br
脱水催化消去把乙烯通入盛有溴水的试管中,溴水的红棕色褪去,说明乙烯与溴发生了加成反应;CH2=CH2+Br2→CH2BrCH2Br
【解析】
具有水果香味液体A(C4H8O2)在酸性条件下水解生成B与C,B能与氨气反应生成铵盐,C氧化生成D,D与银氨溶液反应也生成B的铵盐,则A为酯,B为羧酸,C为醇,且B与C含有相同的碳原子个数,则可推知A为CH3COOCH2CH3,B为CH3COOH,C为CH3CH2OH,D为CH3CHO,乙醇发生消去反应生成E为CH2=CH2,乙烯发生加聚反应生成高聚物G为![]() ,据此解答。
,据此解答。
根据以上分析可知A为CH3COOCH2CH3,B为CH3COOH,C为CH3CH2OH,D为CH3CHO,E为CH2=CH2,G为![]() ,则
,则
(1)根据以上分析可知A为CH3COOCH2CH3,D为CH3CHO,G为![]() 。
。
(2)在C→E的反应属于乙醇的消去反应,浓硫酸的作用是催化剂和脱水剂。
(3)根据以上分析可知C→E反应的类型是加成反应。
(4)乙烯含有碳碳双键,能与溴水发生加成反应,即把乙烯通入盛有溴水的试管中,溴水的红棕色褪去,说明乙烯与溴发生了加成反应,反应的方程式为CH2=CH2+Br2→CH2BrCH2Br。

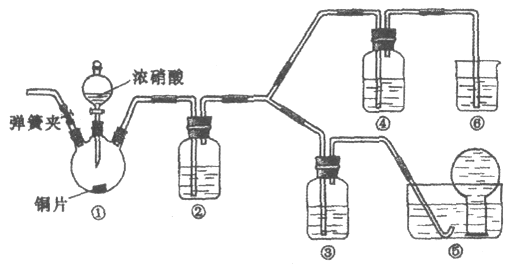
【题目】用图所示装置检验乙烯时不需要除杂的是
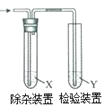
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
【题目】碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容。
(1)已知热化学方程式:①2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH1
②C(s)+O2(g)===CO2(g) ΔH2
③H2(g)+1/2O2(g)===H2O(l) ΔH3
则反应④2C(s)+H2(g)===C2H2(g)的ΔH=_________。(用含ΔH1、ΔH2、ΔH3的关系式表示)
(2)利用上述反应①设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池的负极反应式:__________________________________________ 。
(3)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH<0。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH<0。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/(mol·L-1) 物质 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①10~20 min内,NO的平均反应速率v(NO)=______,T1℃时,该反应的平衡常数K=________。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是________(填字母编号)。
a.通入一定量的NO b.加入一定量的C c.适当升高反应体系的温度
d.加入合适的催化剂 e.适当缩小容器的体积
③若保持与上述反应前30 min的反应条件相同,起始时NO的浓度为2.50 mol·L-1,则反应达平衡时c(NO)=________,NO的转化率=________。