题目内容
【题目】将4molA气体和2molB气体在2L的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g);△H<0。4s后反应达到平衡状态,此时测得C的浓度为0.6 mol·L-1。下列说法中,正确的是
2C(g);△H<0。4s后反应达到平衡状态,此时测得C的浓度为0.6 mol·L-1。下列说法中,正确的是
A. 当A、B、C物质的量浓度之比为2︰1︰2时,反应即达到平衡状态
B. 4s内用物质B表示的反应速率为0.075 molL-1s-1
C. 达平衡后若通入一定量氦气,A的转化率降低
D. 达平衡后若升高温度,C的浓度将增大
【答案】B
【解析】
A. 当同一物质表示的正逆反应速率相等时,该反应达到平衡状态;
B. 先计算C表示的反应速率,再根据同一化学反应中同一时间段内各物质的反应速率之比等于化学计量数之比计算B表示的反应速率;
C. 恒容容器中加入惰性气体,总压增大,但分压不变,平衡不移动,从而确定A的转化率变化情况;
D. 升高温度平衡向吸热方向移动,从而确定C的浓度变化情况。
A. 反应过程中,当A、 B、C的物质的量浓度之比为2:1:2时,各物质的浓度不一定不变,正逆反应速率不一定相等,则反应不一定达到平衡状态,故A错误;
B. 达到平衡时C的浓度为0.6molL1,则C表示的反应速率是0.6molL1÷4s=0.15 mol·L-1·s-1,在同一化学反应中的同一时间段内,各物质表示的反应速率之比等于其化学计量数之比,所以B表示的反应速率是0.15 mol·L-1·s-1÷2=0.075 mol·L-1·s-1,故B正确;
C. 在恒温恒容容器中,反应达到平衡时加入惰性气体,总压增大,各气体分压不变,化学平衡不移动,所以A的转化率不变,故C错误;
D. 该反应的正反应是放热反应,升高温度平衡向逆反应方向移动,所以C的浓度将减小,故D错误,答案选B。

【题目】研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:
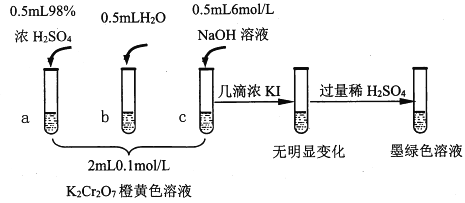
已知:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是_____________________。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?________(“是”或“否”),理由是______。
(3)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是________。
(4)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如下表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验 | ⅰ | ⅱ | ⅲ | ⅳ |
是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨阳极为铁 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
①对比实验ⅰ和实验ⅱ可知,_________(“升高”或“降低”)pH可以提高Cr2O72-的去除率。
②实验ⅱ中Cr2O72-放电的电极反应式为___________________________________。
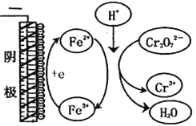
③实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因是_______________ 。