题目内容
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:
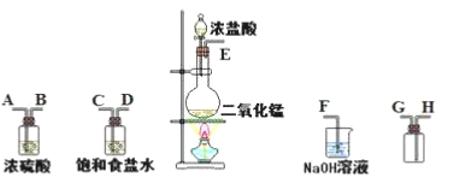
(1)连接上述仪器的正确顺序(填各接口处的字母):___________接_______;________接_________;__________接_________;_________接____________。___________
(2)装置中,饱和食盐水的作用是__________________;NaOH溶液的作用是__________________________________________。
(3)化学实验中常用_____________检验是否有Cl2产生。如果有Cl2产生,可观察到________________,反应方程式_______________________________。
(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应:___________________________
②NaOH溶液中发生的反应:___________________________
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O。
①标出该反应电子转移的方向和数目_________________
②氧化剂和还原剂的物质的量之比为_____________________;
③当有0.2mole-转移时被氧化的HCl的质量是____________;该反应中被氧化和未被氧化的盐酸的物质的量之比是__________,
④如果将20mL12mol/L的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将_____________。
A.≥1.68L B.> 1.68L C.≤1.68L D.<1.68L
【答案】ECDABHGF 除去氯气中的![]() 杂质 吸收过量的氯气 湿润的淀粉碘化钾试纸 试纸变蓝 2KI+Cl2=2KCl+I2 MnO2+4HCl(浓)
杂质 吸收过量的氯气 湿润的淀粉碘化钾试纸 试纸变蓝 2KI+Cl2=2KCl+I2 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O Cl2+2NaOH=NaCl+NaClO+H2O
MnCl2+Cl2↑+2H2O Cl2+2NaOH=NaCl+NaClO+H2O  (或
(或 ) 1∶5 7.3g 5:3 D
) 1∶5 7.3g 5:3 D
【解析】
(1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气;
(2)饱和食盐水是用来除去氯气中的氯化氢气体,氯气有毒,据此分析解答;
(3)氯气具有氧化性,能够氧化碘离子生成单质碘;
(4)①二氧化锰和浓盐酸加热反应生成氯气的反应;②氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;据此书写反应的方程式;
(5)①依据元素化合价的变化,结合氧化还原反应的双线桥或单线桥标出电子转移方向和数目;②依据氧化还原反应中元素化合价的变化判断氧化剂和还原剂,计算氧化剂和还原剂的物质的量之比;③结合①的分析计算;④根据方程式计算,再从浓盐酸易挥发,装置中的氯气不能被全部赶出等因素考虑判断。
(1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,然后排空气法收集氯气,导气管需要长进短出,最后用氢氧化钠溶液吸收多余的氯气,因此装置连接顺序是E-C,D-A,B-H,G-F,故答案为:ECDABHGF;
(2)饱和食盐水是用来除去氯气中的氯化氢气体,降低氯气的溶解度;氯气有毒,会污染空气,用氢氧化钠溶液吸收,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,可以防止尾气污染,故答案为:除去挥发出的氯化氢气体;吸收过量的氯气;
(3)氯气具有氧化性,遇到淀粉碘化钾溶液会氧化碘离子为碘单质,碘遇淀粉变蓝,反应的化学方程式为:2KI+Cl2=2KCl+I2,故答案为:湿润的淀粉碘化钾试纸;试纸变蓝;2KI+Cl2=2KCl+I2 ;
(4)①气体发生装置中发生二氧化锰和浓盐酸加热反应生成氯气的反应,反应的化学方程式为:MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
②氯气有毒,用氢氧化钠溶液吸收,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(5)①2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中锰元素化合价从+7价降低到+2价;氯元素化合价从-1价升高为0价,转移10个电子,电子转移的方向和数目用双线桥可以表示为: ,用单线桥可以表示为:
,用单线桥可以表示为: ,故答案为:
,故答案为: (或
(或 );
);
②2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,锰元素化合价从+7价降低到+2价;氯元素化合价从-1价升高为0价,氧化剂高锰酸钾为2mol,则还原剂HCl为10mol,氧化剂和还原剂的物质的量之比为1∶5,故答案为:1∶5;
③依据化学方程式可知每转移10mol电子,被氧化的HCl为10mol,当有0.2mole-转移时被氧化的HCl的物质的量为0.2mol,质量=0.2mol×36.5g/mol=7.3g;反应中氯化氢中元素化合价变化的被氧化,元素化合价不变的未被氧化,所以该反应中被氧化和未被氧化的盐酸的物质的量之比=10∶6=5∶3,故答案为:7.3g;5∶3;
④将20mL12molL-1的浓盐酸溶液中含有0.24mol HCl,与足量KMnO4充分反应理论上生成氯气的物质的量0.24mol×![]() =0.075mol,标准状况下体积=0.075mol×22.4L/mol=1.68L;反应过程中浓盐酸易挥发,不能完全反应,装置中的氯气不能被全部赶出等因素,导致收集的气体减少,所以实际收集到的氯气体积标准状况下小于1.68L,故答案为:D。
=0.075mol,标准状况下体积=0.075mol×22.4L/mol=1.68L;反应过程中浓盐酸易挥发,不能完全反应,装置中的氯气不能被全部赶出等因素,导致收集的气体减少,所以实际收集到的氯气体积标准状况下小于1.68L,故答案为:D。