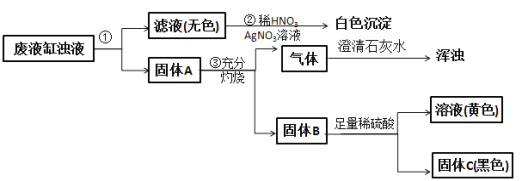
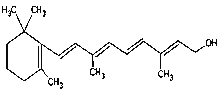
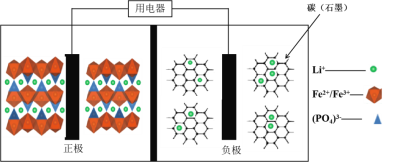
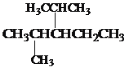题目内容
【题目】Ⅰ.25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11` | 3.0×10-8 |
请回答下列问题:
(1)写出碳酸的第一级电离方程式:________。
(2)物质的量浓度相同的三种溶液:a.CH3COONa b.NaHCO3 c.NaClO
三种溶液的pH由小到大排列的顺序是___<___< ___(用编号填写)
(3)写出向NaClO溶液中通入少量CO2的化学方程式________。
Ⅱ.(4)碳酸钠溶液呈碱性的原因是:______。(写出离子方程式)。0.01mol/L Na2CO3溶液的pH____0.1mol/LNa2CO3溶液的pH。(填“>”或“<”或“==”)
(5)浓度均为0.1mol/L的①CH3COONa溶液②NH4Cl溶液③稀HCl④Na2SO4溶液按pH由大到小的排列顺序为____
(6)打开无水FeCl3的试剂瓶,常冒出许多“白烟”,发生反应的化学方程式为________
【答案】H2CO3![]() HCO3-+H+ a b c NaClO+CO2+H2O=HClO+NaHCO3 CO32-+H2O
HCO3-+H+ a b c NaClO+CO2+H2O=HClO+NaHCO3 CO32-+H2O![]() HCO3-+OH- < ①④②③ FeCl3+3H2O
HCO3-+OH- < ①④②③ FeCl3+3H2O![]() Fe(OH)3+3HCl
Fe(OH)3+3HCl
【解析】
Ⅰ.(1)碳酸是二元弱酸,分步电离;
(2)强碱弱酸盐溶液中,酸根离子对应酸的酸性越强,该离子的水解程度越小,溶液的pH越小;
(3)弱酸的电离平衡常数越大,则酸越强,由于电离平衡常数CH3COOH>H2CO3>HCO3->HClO,则酸性强弱顺序为CH3COOH>H2CO3>HCO3->HClO;
Ⅱ.(4)碳酸钠溶液中存在CO32-的二级水解,导致溶液显碱性;在强碱弱酸盐溶液中,加水促进弱酸根离子的水解;
(5)①CH3COONa是强碱弱酸盐,溶液显弱碱性;②NH4Cl是强酸弱碱盐,溶液显弱酸性;③稀HCl是强酸,溶液显酸性;④Na2SO4是强酸强碱盐,溶液显中性;
(6))FeCl3在溶液中遇水水解,生成氢氧化铁和HCl;
Ⅰ.(1)碳酸是二元弱酸,其第一级电离方程式H2CO3![]() HCO3-+H+;
HCO3-+H+;
(2)三种溶液的溶质都是强碱弱酸盐,水解程度大小为:CO32->ClO->HCO3->CH3COO-,水解均显碱性,水解程度越大,碱性越强,所以碱性顺序是: NaClO>NaHCO3>CH3COONa,即pH由小到大的排列顺序为:CH3COONa<NaHCO3<NaClO,即:pH由大到小的顺序为:abc;
(3)弱酸的电离平衡常数越大,则酸越强,由于电离平衡常数CH3COOH>H2CO3>HCO3->HClO,则酸性强弱顺序为CH3COOH>H2CO3>HCO3->HClO,根据强酸制弱酸的原则,向NaClO溶液中通入少量CO2发生反应的化学方程式为NaClO+CO2+H2O=HClO+NaHCO3;
Ⅱ.(4)碳酸钠溶液中存在CO32-的二级水解,导致溶液显碱性,其水解反应的离子方程式为CO32-+H2O![]() HCO3-+OH-;在强碱弱酸盐溶液中,加水促进弱酸根离子的水解,但溶液的碱性变弱,则0.01mol/L Na2CO3溶液的pH<0.1mol/LNa2CO3溶液的pH;
HCO3-+OH-;在强碱弱酸盐溶液中,加水促进弱酸根离子的水解,但溶液的碱性变弱,则0.01mol/L Na2CO3溶液的pH<0.1mol/LNa2CO3溶液的pH;
(5)浓度均为0.1mol/L的,①CH3COONa是强碱弱酸盐,溶液显弱碱性;②NH4Cl是强酸弱碱盐,溶液显弱酸性;③稀HCl是强酸,溶液显酸性,溶液中H+浓度为0.1mol/L;④Na2SO4是强酸强碱盐,溶液显中性,则按pH由大到小的排列顺序为①④②③;
(6)打开无水FeCl3的试剂瓶,常冒出许多“白烟”, 是FeCl3在溶液中水解生成氢氧化铁和HCl的缘故,发生反应的化学方程式为FeCl3+3H2O![]() Fe(OH)3+3HCl。
Fe(OH)3+3HCl。

【题目】实验室有一未知浓度的盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
配制100mL0.10molL-1NaOH标准溶液。需用托盘天平称量___g的氢氧化钠固体。
取20.00mL待测盐酸放入锥形瓶中,并滴加 2~3滴酚酞作指示剂,用配制的标准 NaOH溶液进行滴定。重复上述滴定操作 2~3次,记录数据如下:
滴定次数 | 待测盐酸的体积/mL | 0.10 mol/L NaOH 溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 20.00 | 2.00 | 28.15 |
第二次 | 20.00 | 1.50 | 29.50 |
第三次 | 20.00 | 0.20 | 26.55 |
①该实验滴定达到终点的标志是_________
②根据上述数据,可计算出该盐酸的浓度约为______。(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。(双选)
A 滴定终点读数时俯视读数 B 酸式滴定管使用前,水洗后未用待测盐酸润洗
C 锥形瓶水洗后未干燥 D 碱式滴定管尖嘴部分有气泡,滴定后消失
E 称量NaOH 固体时,混入少量KOH杂质
④现用以上实验配制的0.10molL-1NaOH溶液滴定未知浓度的CHCOOH溶液,反应恰好完全时,下列叙述中正确的是_____
A 溶液呈中性,可选用甲基橙或酚酞作指示剂
B 溶液呈中性,只能选用石蕊作指示剂
C 溶液呈碱性,可选用甲基橙或酚酞作指示剂
D 溶液呈碱性,只能选用酚酞作指示剂