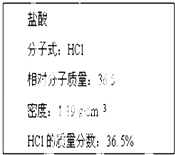
题目内容
【题目】已知(HF)2(g)2HF(g),△H>0且平衡体系的总质量【m(总)】与总物质的量【n总】之比在不同温度下随压强的变化曲线如图所示.下列说法正确的是( ) 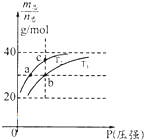
A.温度:T1<T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:Vb>Va
D.当 ![]() =30g/mol时,n(HF):n[(HF)2]=2:1
=30g/mol时,n(HF):n[(HF)2]=2:1
【答案】C
【解析】解:A、根据平衡体系的总质量【m(总)】与总物质的量【n总】之比为混合气体平均摩尔质量,反应是吸热反应,升温平衡正向进行,气体物质的量增大,总质量【m(总)】与总物质的量【n总】之比减小,T1>T2 , 故A错误; B、平衡常数随温度变化,不随压强变化,温度越高,平衡正向进行,平衡常数增大,平衡常数:K(a)=K(c)<K(b),故B错误;
C、分析判断可知T1>T2 , 温度越高反应速率越快,反应速率:Vb>Va , 故C正确;
D、n(HF):n[(HF)2]=2:1,当 ![]() =
= ![]() =26.7g/mol,故D错误;
=26.7g/mol,故D错误;
故选C.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】某实验小组用如图装置制备家用消毒液,并探究其性质.
(1)写出装有浓盐酸的仪器名称 , A中烧瓶内进行的反应中浓盐酸体现出的化学性质是
(2)写出装置B中发生的所有反应化学方程式
(3)装置c的作用是
反应停止后,各取洗气瓶中无色溶液5mL分别进行了如下实验:
操作 | 现象 |
A.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
B. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(4)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去
为探究操作A中溶液褪色的原因,又补充了如下实验:
操作 | 现象 |
取 NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
获得结论:此实验小组制备的消毒液具有漂白性.
(5)操作B中溶液变成黄绿色的原因:(用离子方程式表示).