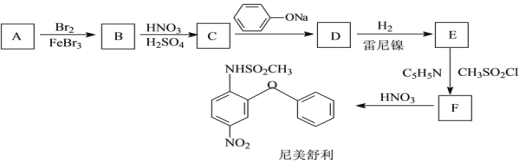
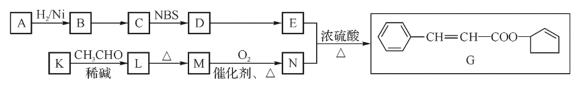
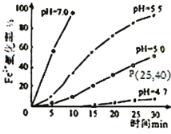
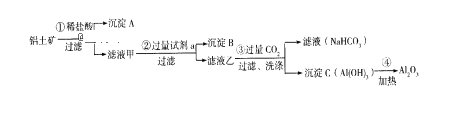
题目内容
【题目】t ℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K=![]() 。有关该平衡体系的说法正确的是
。有关该平衡体系的说法正确的是
A. 当混合气体的平均相对分子质量保持不变时,反应达平衡
B. 增大压强,各物质的浓度不变
C. 升高温度,平衡常数K增大
D. 增加X的量,平衡既可能正向移动,也可能逆向移动
【答案】A
【解析】
根据平衡常数表达式分析,化学反应中Y为生成物且为气体,化学计量数为2,;Z、W为反应物,是气体,化学计量数都为1,X为固体或纯液体。
A、当混合气体的平均相对分子质量不变时,说明反应体系中X的质量不变,反应到平衡,正确,选A;
B、增大压强,气体物质的浓度增大,错误,不选B;
C、升温,平衡常数肯定改变,但不一定增大,由平衡移动的方向决定,错误,不选C;
D、增加X的量,其浓度不变,平衡不移动,错误,不选D。
故选A。

练习册系列答案
相关题目