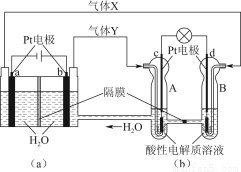
题目内容
下列叙述正确的是( )
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液浓度大小关系为:c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D
【解析】等浓度的CH3COONa溶液和Na2CO3溶液,由于CO32—的水解程度大于CH3COO-的水解程度,Na2CO3溶液的碱性强于CH3COONa溶液的碱性,故等pH的两溶液,CH3COONa溶液的浓度大,A项错误;0.1 mol/L NaHA溶液的pH=4,说明溶液中存在HA-的电离和水解,且电离程度大于水解程度,电离产生H+和A2-,水解产生H2A和OH-,故c(A2-)>c(H2A),B项错误;使醋酸的pH增大1,需要将醋酸稀释的倍数要远大于10倍,C项错误;pH=11的NaOH溶液中c(OH-)=10-3 mol·L-1,pH=3的醋酸溶液中c(H+)=10-3 mol·L-1,但醋酸的浓度远大于NaOH溶液的浓度,二者等体积混合后醋酸过量,溶液呈酸性,滴入石蕊溶液呈红色

 阅读快车系列答案
阅读快车系列答案工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等。
已知:
①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。
③下表为一些金属氢氧化物沉淀的pH参照数据。
物质 | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.7 | 4.7 |
Cr(OH)3 | 4.7 | a |
Fe(OH)2 | 7.6 | 9.6 |
Mg(OH)2 | 9.6 | 11.1 |
回答下列处理铬渣、消除铬污染的有关问题:
(1)将铬渣用稀硫酸浸取、过滤,在浸出液中加入适量的绿矾(FeSO4·7H2O),加入绿矾的目的是_____________________________________________
(2)再向浸出液中缓慢加入烧碱,至pH刚好达到4.7,过滤,所得沉淀的化学式是____________________________________________________________;
常温下,Cr(OH)3的溶度积Ksp=10-32,要使Cr3+完全沉淀[c(Cr3+)降至10-5 mol·L-1视为沉淀完全],溶液的pH应调于a=________。
(3)向(2)中得到的滤液中加入硫酸,调节至呈强酸性,所得的溶液是含____________________溶质的溶液。