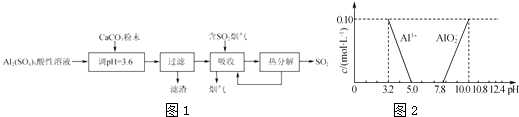
��Ŀ����
����Ŀ����Ҫ�����
��1��H3PO3��NaOH��Ӧֻ����NaH2PO3��Na2HPO3������,��H3PO3Ϊ____Ԫ�ᣬNa2HPO3Ϊ_____(����������������ʽ����)��
��2�����������£�������(H3PO2)�ɷ������з�Ӧ�����ڻ�ѧ������
Ag++��H3PO2+�� =��Ag+��H3PO4+��
�Իش���������
�ٸ÷�Ӧ������������_________��
���뽫��Ӧ��������ﲹ����������ƽ�����õ����ŷ��������ת�Ƶ���Ŀ_________��
������Ӧ������10.8gAg,��ת�Ƶ��ӵ���ĿԼΪ________��
��3����ͬ�¡�ͬѹ�£�ʵ����CO2��O2��������Ļ��������ܶ���H2��20������û�������ƽ��Ħ������Ϊ______������O2���������Ϊ______(����3λ��Ч����)��
��4�����³�ѹ�£���0.2mol�ơ�þ�ֱ���뵽100mL1mol/L�������У����������������Ϊ___��
���𰸡� �� ���� H3PO4 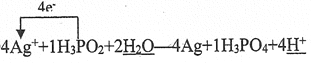 6.02��1022��0.1NA 40g/mol 33.3% 2:1
6.02��1022��0.1NA 40g/mol 33.3% 2:1
����������1��H3PO3��NaOH��Ӧֻ����NaH2PO3��Na2HPO3������,��˵��H3PO3ֻ�ܵ����2�������ӣ�Ϊ��Ԫ�ᣬ��Na2HPO3Ϊ���Σ��ʴ�Ϊ���� �����Σ���2�������ݷ�Ӧ��������Ԫ�ػ��ϼ����ߣ���������Ϊ��������ʴ�Ϊ��H3PO4 ����Ԫ�ػ��ϼ�����4�ۣ���Ԫ�ػ��ϼ۽���1�ۣ����������Ӻ͵ı���Ϊ4:1������ԭ���غ���ƽ����ʽ����Ӧ��ת��4�����ӣ��ʵ����ű�ʾΪ��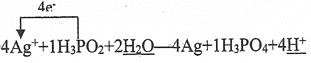 ��������10.8g������0.1mol����ת��0.1mol���ӣ���6.02��1022��0.1NA����3����ͬ�¡�ͬѹ�£��ܶȱȵ���Ħ������֮�ȷ�������������ƽ��Ħ������Ϊ40g/mol�������������������Ϊx������44��1-x��+32x=40����x=33.3% ����4��0.2mol����ȫ��Ӧ����0.1mol������0.2molþ��ʣ�࣬������ȫ��Ӧ������0.05mol���������߱���Ϊ0.1:0.05=2:1��
��������10.8g������0.1mol����ת��0.1mol���ӣ���6.02��1022��0.1NA����3����ͬ�¡�ͬѹ�£��ܶȱȵ���Ħ������֮�ȷ�������������ƽ��Ħ������Ϊ40g/mol�������������������Ϊx������44��1-x��+32x=40����x=33.3% ����4��0.2mol����ȫ��Ӧ����0.1mol������0.2molþ��ʣ�࣬������ȫ��Ӧ������0.05mol���������߱���Ϊ0.1:0.05=2:1��

 Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д� �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�