��Ŀ����
����Ŀ��ʵ������������������Һ�Ʊ������Եļ�ʽ������[Ala��SO4��b��OH��c]�������������������������Ĺ�����ͼ1�� 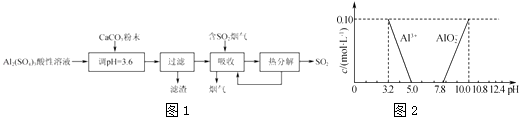
��1����CaCO3������Һ��pH��3.6����Ŀ�����к���Һ�е��ᣬ��ʹAl2��SO4��3ת��ΪAla��SO4��b��OH��c �� ����ʱ���õIJ��������������ձ�����������Ҫ�ɷ�Ϊ���ѧʽ����
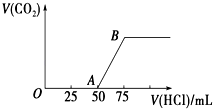
��2�����������о���ȫ�ȷֽ�ų���SO2������С�����յ�SO2��������Ҫԭ������������SO2ǰ����Һ��ȣ��ȷֽ��ѭ�����õ���Һ��pH�����������С�����䡱����
��3��Ala��SO4��b��OH��c��a��b��c�Ĵ�����ϵʽΪ ��
��4����֪�ڳ�������Һ��Al3+��AlO2����Ũ������ҺpH�Ĺ�ϵ��ͼ2��ʾ��Ϊȷ����ʽ����������ɣ���������ʵ�飺 ��ȡ2.18g��ʽ��������Ʒ�ڿ��������������أ���Ʒ����������0.36g��
����ȡ2.18g��ʽ����������ˮ��������Һ��pH��5.0��7.8��
�۽��ڲ����ij������ˡ�ϴ�ӡ����������أ�����ʣ�����Ϊ1.02g��
�������Ʒ��Al3+��SO42�������ʵ���֮�ȣ�д��������̣���
���𰸡�
��1��©������������CaSO4
��2����Һ�еIJ���SO32�� ��������SO42������С
��3��3a=2b+c
��4���⣺�ɲ���ٿ�֪n��H2O��=0.36 g/18 gmol��1=0.02 mol������n��OH����=0.02 mol��2=0.04 mol��
�ɢۿ�֪1.02 gΪAl2O3����n��Al2O3��=1.02 g/102 gmol��1=0.01 mol��������Ʒ��n��Al3+��=0.02 mol ���ݵ���غ��֪����Ʒ��n��SO42����=��0.02 mol��3��0.04 mol��/2=0.01 mol������n��Al3+����n��SO42����=0.02 mol��0.01mol=2��1��
����Ʒ��Al3+��SO42�������ʵ���֮��Ϊ2��1��
���������⣺�������̿�֪��Al2��SO4��3��Һ�м���CaCO3������Һ��pH��3.6��ʹAl2��SO4��3ת��ΪCaSO4���������˵�����ΪCaSO4 �� ��Һ�к��������ӡ���������ӵȣ����պ��ж������������������Һ����������������ӣ�������������ӻᱻ�������������ᣬ����Һ�ټ����������ηֽ����ɶ�������������Һѭ������������������������1������ʱ���õIJ���������©�������������ձ���ͨ�����Ϸ���֪�������ijɷ���CaSO4 �� ���Դ��ǣ�©������������CaSO4����2����Һ���ն�����������SO32�� �� ����Һ��SO32���ױ���������SO42�� �� �������������о���ȫ�ȷֽ�ų���SO2������С�����յ�SO2������Һ��SO32��������������ӱ���������Ϊת��ΪSO42�� �� SO42��Ϊǿ������ӣ�����Һ������ǿ��pH��С��
���Դ��ǣ���Һ�еIJ���SO32�� ��������SO42������С����3�����ݻ������л��ϼ۴�����Ϊ���֪abc�Ĺ�ϵΪ3a=2b+c��
���Դ��ǣ�3a=2b+c��