题目内容
根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | | FeBr2 | / | | Cl- |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6NA
D.表中③组反应的离子方程式为:2MnO4—+3H2O2+6H+
 2Mn2++4O2↑+6H2O
2Mn2++4O2↑+6H2O
A
解析

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
下列反应中,氧化剂与还原剂的物质的量之比为1:2的是
①O3+2KI+H2O=2KOH+I2+O2 ②SiO2+2C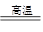 Si+2CO↑
Si+2CO↑
③SiO2+3C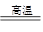 SiC+2CO↑ ④4HCl(浓)+MnO2
SiC+2CO↑ ④4HCl(浓)+MnO2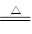 MnCl2+Cl2↑+2H2O( )
MnCl2+Cl2↑+2H2O( )
| A.仅有② | B.②④ | C.②③④ | D.①②③④ |
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2 Si3N4+6CO。下列叙述正确的是( )
Si3N4+6CO。下列叙述正确的是( )
| A.在氮化硅的合成反应中,N2是还原剂,SiO2是氧化剂 |
| B.上述反应中每生成1 mol Si3N4,N2得到12 mol电子 |
| C.若已知上述反应为放热反应,升高温度,其平衡常数增大 |
| D.若使压强增大,上述平衡向正反应方向移动 |
氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是( )
| A.2Na2O2+2CO2=2Na2CO3+O2 | B.2NaHCO3=Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 | D.Cl2+2KBr=Br2+2KCl |
向酸化过的MnSO4溶液中滴加(NH4)2S2O8(过二硫酸铵)溶液会发生反应:Mn2++S2O82-+H2O―→MnO4-+H++SO42-。下列说法不正确的是( )
| A.可以利用该反应检验Mn2+ |
| B.氧化性比较:S2O82->MnO4- |
| C.MnSO4溶液可以使用盐酸酸化 |
| D.若有0.1 mol氧化产物生成,则转移电子0.5 mol |
物质的量之比为1∶3的锌与稀硝酸混合,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法中正确的是( )
| A.在此反应中硝酸体现强氧化性,全部被还原 |
| B.向反应后的溶液中再加入金属铁,不再发生化学反应 |
| C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4 |
| D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5 |
二氧化氯(ClO2)是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用。以下是某校化学研究小组设计实验室制取ClO2的工艺流程图。下列有关说法正确的是( )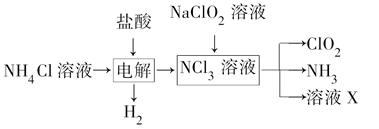
A.电解时发生反应的化学方程式为2HCl Cl2↑+H2↑ Cl2↑+H2↑ |
| B.由NaClO2溶液制取0.6 mol ClO2时,至少消耗0.1 mol NCl3 |
| C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3 |
| D.溶液X的主要成分为NaClO2和NaOH |
在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法错误的是 ( )。
| A.在该反应中碘酸钠作还原剂 |
| B.碱性条件下,氯气的氧化性强于高碘酸钠的氧化性 |
| C.反应中生成1 mol Na2H3IO6转移2 mol电子 |
| D.反应中氧化产物与还原产物的物质的量之比为2∶1 |
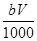 mol
mol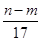 mol
mol L
L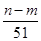 +
+