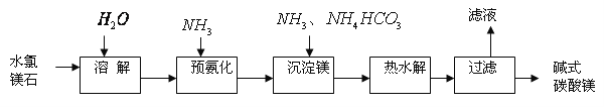
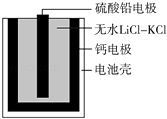
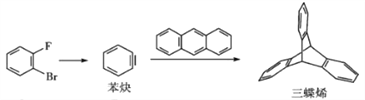
��Ŀ����
����Ŀ�����и�������ʾ��ͼһ�µ���
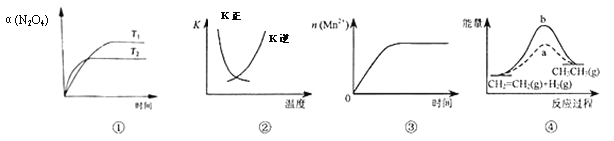
A. ͼ�ٱ�ʾN2O4(g)![]() 2NO2(g) ��H��0��N2O4ת�������¶ȡ�ʱ��ı仯
2NO2(g) ��H��0��N2O4ת�������¶ȡ�ʱ��ı仯
B. ͼ�������߱�ʾ��Ӧ2SO2(g)+O2(g)![]() 2SO3(g) ��H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
2SO3(g) ��H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
C. ͼ�۱�ʾ10 mL0.01 mol/LKMnO4������Һ�����0.1mol/LH2C2O4��Һ���ʱ��n(Mn2+)��ʱ��ı仯
D. ͼ����a��b���߷ֱ��ʾ��ӦCH2��CH2(g)+H2(g)![]() CH3CH3(g) ��H��0��ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
CH3CH3(g) ��H��0��ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
���𰸡�B
���������������ȹ���ƽ���� ![]() ����H��0�������¶�ƽ�������ƶ���N2O4��ƽ��ת��������A������2SO2(g)+O2(g)
����H��0�������¶�ƽ�������ƶ���N2O4��ƽ��ת��������A������2SO2(g)+O2(g)![]() 2SO3(g) ��H��0�������¶�ƽ�������ƶ���
2SO3(g) ��H��0�������¶�ƽ�������ƶ��� ![]() ��С��
���� ![]() ��
��![]() ��Ϊ���������������¶�
��Ϊ���������������¶�![]() ��������B��ȷ���÷�Ӧ�Ƿ��ȷ�Ӧ����Ӧ���ɵ�Mn2+�Ը÷�Ӧ�д����ã��ʷ�Ӧ����Խ��Խ�죬���Ǻ㶨���ʣ���C������÷�Ӧ�Ƿ��ȷ�Ӧ��Ӧ��Ӧ������������������������������ͼ�����������ȷ�Ӧ����D������
��������B��ȷ���÷�Ӧ�Ƿ��ȷ�Ӧ����Ӧ���ɵ�Mn2+�Ը÷�Ӧ�д����ã��ʷ�Ӧ����Խ��Խ�죬���Ǻ㶨���ʣ���C������÷�Ӧ�Ƿ��ȷ�Ӧ��Ӧ��Ӧ������������������������������ͼ�����������ȷ�Ӧ����D������

 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д� �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�����Ŀ����һ����ɱ���ܱ������У�����һ������X��Y��������ӦmX��g��![]() nY��g������H =QkJ/mol����Ӧ�ﵽƽ��ʱ��Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ���±���ʾ��
nY��g������H =QkJ/mol����Ӧ�ﵽƽ��ʱ��Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ���±���ʾ��
| 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.09 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
����˵����ȷ����
A.m��n B. �¶Ȳ��䣬ѹǿ����Y��������������
C. Q��0 D.������䣬�¶����ߣ�ƽ�����淴Ӧ�����ƶ�