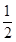题目内容
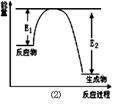
(17分)氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2 + 6C + 2N2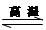 Si3N4 + 6CO,该反应过程中的能量变化如图⑵所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图⑵所示;回答下列问题:
(1)上述反应中的还原剂是 ,还原产物是 。
(2)该反应是 (填“吸热”或“放热”)反应。
(3)在一定温度下,上述反应在4L密闭容器内进行,用M、N两种物质描述其物质的量随时间变化的曲线如图⑶所示:

①M、N表示的物质分别为 、 。
②比较t2时刻,正逆反应速率大小 (正)
(正)  (逆)。
(逆)。
(填“>”、“=”、“<”)。.
③若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为 。
④t3时刻化学反应达到平衡时反应物的转化率为 。
(4)①某种氢燃料电池是用固体金属氧化物陶瓷作电解质,某电极上发生的电极反应为:A极H2-2e-+O2-===H2O;则A极是电池的 极 (填“正”或“负”)。
②上述合成氮化硅的反应产生的尾气不能排放,经过处理以后可以用下图所示的仪器测量尾气中CO的含量。多孔电极中间的固体氧化锆—氧化钇为电解质,这种固体电解质允许O2-在其间通过,其工作原理如图⑷所示,其中多孔Pt电极a、b分别是气体CO、O2的载体。

Ⅰ.该电池的正极为 (填a或b);O2 流向 (填 “正极”或“负极”)
Ⅱ.该电池的正极反应式为 ,负极反应式为 。
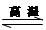 Si3N4 + 6CO,该反应过程中的能量变化如图⑵所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图⑵所示;回答下列问题:
(1)上述反应中的还原剂是 ,还原产物是 。
(2)该反应是 (填“吸热”或“放热”)反应。
(3)在一定温度下,上述反应在4L密闭容器内进行,用M、N两种物质描述其物质的量随时间变化的曲线如图⑶所示:

①M、N表示的物质分别为 、 。
②比较t2时刻,正逆反应速率大小
 (正)
(正)  (逆)。
(逆)。(填“>”、“=”、“<”)。.
③若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为 。
④t3时刻化学反应达到平衡时反应物的转化率为 。
(4)①某种氢燃料电池是用固体金属氧化物陶瓷作电解质,某电极上发生的电极反应为:A极H2-2e-+O2-===H2O;则A极是电池的 极 (填“正”或“负”)。
②上述合成氮化硅的反应产生的尾气不能排放,经过处理以后可以用下图所示的仪器测量尾气中CO的含量。多孔电极中间的固体氧化锆—氧化钇为电解质,这种固体电解质允许O2-在其间通过,其工作原理如图⑷所示,其中多孔Pt电极a、b分别是气体CO、O2的载体。

Ⅰ.该电池的正极为 (填a或b);O2 流向 (填 “正极”或“负极”)
Ⅱ.该电池的正极反应式为 ,负极反应式为 。
(1)C;Si3N4 ;(2)放热 ;(3)① CO 、N2; ② (正) >
(正) >  (逆)③ 1mol/(L·min);④ 75% ;
(逆)③ 1mol/(L·min);④ 75% ;
(4)① 负 。②Ⅰ. b ;负极; Ⅱ.正极反应为O2+4e-===2O2- ;负极反应为CO-2e-+O2-===CO2。
 (正) >
(正) >  (逆)③ 1mol/(L·min);④ 75% ;
(逆)③ 1mol/(L·min);④ 75% ;(4)① 负 。②Ⅰ. b ;负极; Ⅱ.正极反应为O2+4e-===2O2- ;负极反应为CO-2e-+O2-===CO2。
试题分析:(1)在反应3SiO2 + 6C + 2N2
 Si3N4 + 6CO中C的化合价由0价→+2价,作还原剂,N元素的化合价由反应前的N2的0价→-3价,得到电子,作氧化剂,变为还原产物Si3N4。(2)由于反应物的能量比生成物的能量高,多余的能量释放出来。所以该反应是放热反应。(3)①由图像可知M是生成物,N的反应物。在反应方程式中,反应物中只有N2是气体,生成物中只有CO是气体,因此M是CO ,N是N2。②在t2时刻,CO 和N2的物质的量浓度相等,由于反应还没有达到平衡,此时正逆反应速率大小
Si3N4 + 6CO中C的化合价由0价→+2价,作还原剂,N元素的化合价由反应前的N2的0价→-3价,得到电子,作氧化剂,变为还原产物Si3N4。(2)由于反应物的能量比生成物的能量高,多余的能量释放出来。所以该反应是放热反应。(3)①由图像可知M是生成物,N的反应物。在反应方程式中,反应物中只有N2是气体,生成物中只有CO是气体,因此M是CO ,N是N2。②在t2时刻,CO 和N2的物质的量浓度相等,由于反应还没有达到平衡,此时正逆反应速率大小 (正)>
(正)> (逆),反应正向进行。③若t2=2min,从反应开始到t2时刻,V(M)=" (4mol/L-2mol/L)" ÷2min="1mol/(L·min)." ④t3时刻化学反应达到平衡时反应物的转化率为(6mol/L÷8mol/L)×100%="75%" ;(4)①由于A电极失去电子,A极是电池的负极;②Ⅰ. 通入燃料CO的电极为负极,通入氧气的电极为正极。由于b电极通入了氧气,所以该电池的正极为b ;根据同种电荷相互排斥,异种电荷相互吸引的原则,O2-会向正电荷较多的负极移动;Ⅱ.对于该燃料电池来说,正极反应为O2+4e-===2O2- ;负极反应为CO-2e-+O2-===CO2。该电池的总方程式为2CO+O2===CO2。
(逆),反应正向进行。③若t2=2min,从反应开始到t2时刻,V(M)=" (4mol/L-2mol/L)" ÷2min="1mol/(L·min)." ④t3时刻化学反应达到平衡时反应物的转化率为(6mol/L÷8mol/L)×100%="75%" ;(4)①由于A电极失去电子,A极是电池的负极;②Ⅰ. 通入燃料CO的电极为负极,通入氧气的电极为正极。由于b电极通入了氧气,所以该电池的正极为b ;根据同种电荷相互排斥,异种电荷相互吸引的原则,O2-会向正电荷较多的负极移动;Ⅱ.对于该燃料电池来说,正极反应为O2+4e-===2O2- ;负极反应为CO-2e-+O2-===CO2。该电池的总方程式为2CO+O2===CO2。
练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
 xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:

 。
。 CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,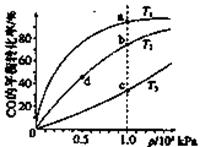
 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
 2H2↑+O2↑
2H2↑+O2↑ 2H2+O2
2H2+O2 2H2↑+O2↑
2H2↑+O2↑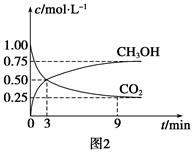

 2NH3达到化学平衡状态,下列说法一定正确的是
2NH3达到化学平衡状态,下列说法一定正确的是