题目内容
25℃时,0.1 mol·L-1的某酸HA溶液中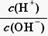 =1010,请回答下列问题:
=1010,请回答下列问题:
(1)HA是 酸(填“强”或“弱”),写出其电离方程式 。
(2)在加水稀释HA的过程中,随着水量的增加而减小的是________(填字母)。
(3)已知100℃时水的离子积是1.0×10—12,在此温度下,有pH=3的盐酸和pH=3的HA的两种溶液
①取等体积两溶液,分别稀释到pH=4时,两者加水量的关系是:前者________后者(填>、<或=,下同);
②取等体积的两溶液,分别加入等物质的量的相应钠盐固体少量,两溶液的pH大小关系是:前者________后者;
③50mL pH=3的盐酸溶液和50mL 0.003mol/LNaOH溶液混合后溶液的pH=_____________.
④pH=3的HA溶液中由水电离出的c(H+)= mol/L
(4)如何通过化学实验来证明HA是弱酸还是强酸,请写出其中的一种化学实验方法:
。
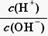 =1010,请回答下列问题:
=1010,请回答下列问题:(1)HA是 酸(填“强”或“弱”),写出其电离方程式 。
(2)在加水稀释HA的过程中,随着水量的增加而减小的是________(填字母)。
A.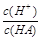 | B.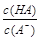 | C.c(H+)·c(OH-) | D.c(OH-) |
①取等体积两溶液,分别稀释到pH=4时,两者加水量的关系是:前者________后者(填>、<或=,下同);
②取等体积的两溶液,分别加入等物质的量的相应钠盐固体少量,两溶液的pH大小关系是:前者________后者;
③50mL pH=3的盐酸溶液和50mL 0.003mol/LNaOH溶液混合后溶液的pH=_____________.
④pH=3的HA溶液中由水电离出的c(H+)= mol/L
(4)如何通过化学实验来证明HA是弱酸还是强酸,请写出其中的一种化学实验方法:
。
(1)弱 HA H++A-
H++A-
(2)B
(3)< < 9 1×10-9
(4)测0.1mol/L HA 的PH,若PH=1为强酸, 若PH>1为弱酸.(答案合理即可)
 H++A-
H++A-(2)B
(3)< < 9 1×10-9
(4)测0.1mol/L HA 的PH,若PH=1为强酸, 若PH>1为弱酸.(答案合理即可)
试题分析:(1)25℃时,Kw=10-14,由
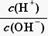 =1010得c(H+)="0.01" mol·L-1,c(HA)=" 0.1" mol·L-1,所以HA是弱酸。
=1010得c(H+)="0.01" mol·L-1,c(HA)=" 0.1" mol·L-1,所以HA是弱酸。(2)
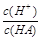 =
=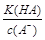 ,稀释HA的过程中,c(A-)减小、K(HA)不变,
,稀释HA的过程中,c(A-)减小、K(HA)不变,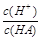 增大,A错误;
增大,A错误;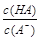 =
=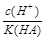 ,稀释过程中c(H+)减小、K(HA)不变,
,稀释过程中c(H+)减小、K(HA)不变,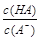 减小,B正确;c(H+)·c(OH-)=Kw,Kw随温度变化而变化,c(H+)·c(OH-)不变,C错误;稀释HA过程中,c(H+)减小、c(OH-)增大,D错误。
减小,B正确;c(H+)·c(OH-)=Kw,Kw随温度变化而变化,c(H+)·c(OH-)不变,C错误;稀释HA过程中,c(H+)减小、c(OH-)增大,D错误。(3)①若HCl和HA加水稀释相同的倍数后盐酸pH大,要使pH相同,HA需再稀释,所以HA中加入水多。
②盐酸中加少量氯化钠固体,pH不变;HA中加少量NaA固体,HA电离平衡向左移动,c(H+)减小,所以HA溶液pH大。
③50mL pH=3的盐酸溶液和50mL 0.003mol/LNaOH溶液混合后溶液中c(OH-)=
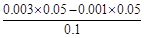 =0.001mol/L,c(H+)=10-9mol/L,pH=9。
=0.001mol/L,c(H+)=10-9mol/L,pH=9。④pH=3的HA溶液中c(OH-)=10-9mol/L,由水电离出的c(H+)=10-9mol/L。
(4)证明HA是弱酸方法很多。如可测定0.1mol/LHA溶液pH,若pH=1,则为强酸,若pH>1,则HA为弱酸;测定0.1mol/LNaA溶液pH,若pH=7,由HA为强酸。若pH>7,则HA为弱酸;比较同温度、同浓度HA与盐酸导电性等。
点评:常温下,水的离子积为10-14,中性溶液pH=7。100时水的离子积为10-12,此时pH=7的溶液不呈中性,而是呈碱性。

练习册系列答案
相关题目
 2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果 实验数据
实验数据