题目内容
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中Cl﹣与SO42﹣之比为( ) 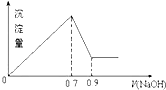
A.2:3
B.1:3
C.3:2
D.2:1
【答案】B
【解析】解:根据离子方程式Al3++3OH﹣=Al(OH)3、Mg2++2OH﹣=Mg(OH)2、Al(OH)3+OH﹣=AlO2﹣+2H2O并结合图象可知,溶解氢氧化铝消耗氢氧化钠的体积是0.2mL,则生成氢氧化铝消耗的氢氧化钠溶液体积为0.6mL,所以生成氢氧化镁消耗的氢氧化钠是0.1mL,铝离子和镁离子消耗氢氧化钠溶液的物质的量之比为:6:1,
则Al3+和Mg2+的物质的量之比为:(6× ![]() ):(1×
):(1× ![]() )=4:1,
)=4:1,
结合化学式MgCl2、Al2(SO4)3可知,溶液中Cl﹣与SO42﹣的物质的量之比为:(1×2):(4× ![]() )=1:3,
)=1:3,
故选B.
发生反应有:Al3++3OH﹣=Al(OH)3、Mg2++2OH﹣=Mg(OH)2、Al(OH)3+OH﹣=AlO2﹣+2H2O,根据图象可知生成溶解氢氧化铝消耗了0.2mL氢氧化钠,则生成氢氧化铝沉淀消耗了0.6mL氢氧化钠,故生成氢氧化镁沉淀消耗了0.1mL氢氧化钠,据此计算出镁离子与铝离子的物质的量之比,再结合二者化学式计算出氯离子和硫酸根离子的物质的量之比.

练习册系列答案
相关题目
【题目】下表为各物质中所含有的少量杂质,以及除去这些杂质应选用的试剂或操作方法.其中正确的是( )
选项 | A | B | C | D |
物质 | KNO3溶液 | CO2 | 水 | 乙醇 |
杂质 | KOH | H2O(g) | 溴 | 水 |
除杂试剂 | FeCl3溶液 | 浓硫酸 | 酒精 | 生石灰 |
除杂装置 |
|
|
|
|
A.A
B.B
C.C
D.D